
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
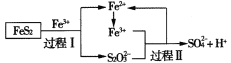
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
【答案】B
【解析】
A. 在过程I中发生反应,使S22-转化为S2O32-,S元素化合价由反应前-1价变为反应后+2,S元素化合价共升高2×3=6价,失去6 mol电子,每溶解120 g即1 mol FeS2,反应转移6 mol电子,根据电子守恒可知需消耗6 mol Fe3+,A正确;
B. 在过程II中Fe3+将S2O32-氧化为SO42-,S元素化合价由反应前+2价变为反应后的+6价,每1 mol S2O32-反应产生2 mol SO42-,元素化合价共升高2×4=8价,则产生1 mol SO42-转移4 mol e-,B错误;
C. 根据示意图可知FeS2与Fe3+及H2O发生反应后最终变为SO42-、Fe2+及H+,根据电子守恒、电荷守恒及原子守恒,可得反应总方程式为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,C正确;
D. 反应过程中鼓入大量的空气,可以将其中S元素氧化为SO2,将+2价Fe氧化为Fe3+,在溶液中Fe3+进一步把SO2氧化为SO42-,可见鼓入足量空气将促使反应正向进行,有利于反应的进行,D正确;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5mol/L的硫酸溶液450mL,需用量筒量取质量分数98%、密度1.84g/cm3的浓硫酸的体积为___mL,如果实验室有15mL、20mL、50mL量筒,应最好选用___mL量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是___。
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是__(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)配制时,其正确的操作顺序是___(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配稀硫酸溶液浓度偏高的是__(填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
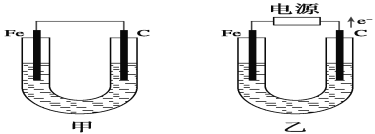
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_______________________________。
②甲池中碳极上电极反应式是____________________________,乙池碳极上电极反应属于______________(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中电解质溶液体积是200 mL,则溶液混合均匀后的c(OH—)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,其中B、C、D 焰色反应均为黄色,而A的焰色反应为紫色,B、D和盐酸反应均得到C,将固体B加热分解可得到D,若在D的溶液中通入一种无色无味气体,又可得到B的溶液;若A的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式:
A:___ B:___ C:___
(2)按要求写出下列方程式:
①D与盐酸反应的离子方程式:___;
②E固体受热分解的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为_____________,在上述反应的生成物中,属于分子晶体的的电子式__________。
(2)反应中单质物质的原子核外共有______种不同形状的电子云,该原子最外层电子的能量 ______上述方程式中同主族的另一元素原子的最外层电子能量(选填“高于”“低于”或“等于”)。
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是___(选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,Na2CO3溶液比Na2SO4溶液碱性______(选填“强”或“弱”)用离子方程式说明原因:__________________。(选填“冷”或“热”)的纯碱水易于除油污,简要说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图: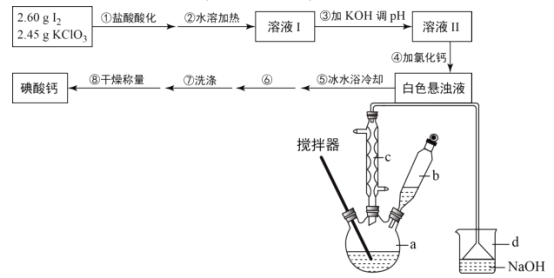
物质的摩尔质量如下表:
物质 | I2 | KClO3 | Ca(IO3)2 |
摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___(填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___。
(5)步骤⑥的操作名称为___。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸(![]() ) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
(1)乳酸可发生的化学反应类型有__________。
a.取代反应 b.加成反应 c.氧化反应 d.还原反应
(2)与乳酸含有相同官能团的同分异构体的结构简式_______________。
(3)相同物质的量的乳酸分别与足量的金属钠和氢氧化钠溶液反应,消耗的金属钠与氢氧化钠的物质的量之比是__________。
(4)两个乳酸分子在一定条件下发生酯化反应既能生成六元环状化合物M,又能得到链状化合物N,则M、N的结构简式分别是________,________。
(5)可降解一次性餐盒是由乳酸在一定条件下通过___________(填反应类型)生成的高分子材料制得,合成这种高分子材料的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com