

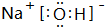 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.分析 由元素在周期表中位置,知①为H、②为C、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为Si、⑨为Cl.
(1)同周期自左而右非金属性增强(稀有气体除外)、同主族自上而下非金属性减弱;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(3)由①、③、⑥、⑨四种元素中的三种形成的化合物有NaOH、NaClO、HClO等;
(4)元素非金属性增强,其最高价氧化物的水化物的酸性越强;
(5)电解氯化钠溶液,阳极发生氧化反应,氯离子在阳极失去电子生成氯气.
解答 解:由元素在周期表中位置,知①为H、②为C、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为Si、⑨为Cl.
(1)同周期自左而右非金属性增强(稀有气体除外)、同主族自上而下非金属性减弱,故F元素非金属性最强,处于周期表中第二周期VIIA族,故答案为:第二周期VIIA族;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Al>C>O,故答案为:Al>C>O;
(3)由①、③、⑥、⑨四种元素中的三种形成的化合物有NaOH、NaClO、HClO等,NaOH电子式为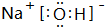 ,属于离子晶体,故答案为:
,属于离子晶体,故答案为: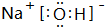 ;离子晶体;
;离子晶体;
(4)非金属性:Cl>C>Si,元素非金属性增强,其最高价氧化物的水化物的酸性越强,故酸性:HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(5)电解氯化钠溶液,阳极发生氧化反应,氯离子在阳极失去电子生成氯气,阳极电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑.
点评 本题考查元素周期表与元素周期律,比较基础,注意掌握微粒半径比较与金属性、非金属性强弱比较.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应开始时,甲中石墨电极上Fe3+被还原 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 平衡时甲中溶入FeCl2固体后,电流计读数为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
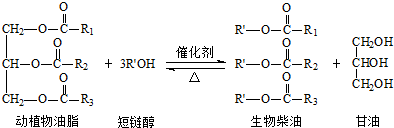
| A. | 生物柴油是不同酯组成的混合物 | B. | 动植物油脂是高分子化合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 生物柴油由可再生资源制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40gSiC晶体中含有2NA个Si-C共价键 | |
| B. | 标准状况下,22.4LCl2作为反应物参加反应时,转移的电子数一定为2NA | |
| C. | 1mol的CH≡CH中,所含σ键的总数为3NA | |
| D. | 常温常压下,100mL0.5mol/L的醋酸溶液中,醋酸根离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 油脂水解的产物是氨基酸和甘油 | |
| D. | 淀粉和聚乙烯都是天然髙分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
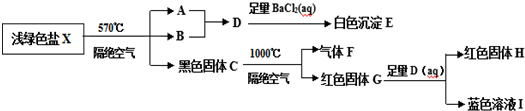
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com