
| A. | 向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 将Na2O2放入H2O中:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| C. | 向NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将稀盐酸与84消毒液混合:C1-+C1O-+2H+═C12↑+H2O |
分析 A.溴水过量,亚铁离子和碘离子都完全被氧化,亚铁离子和溴离子的物质的量关系错误;
B.过氧化钠与水反应生成氢氧化钠和氧气,不会生成氢气;
C.氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写;
D.84消毒液的再主要成分为次氯酸钠,次氯酸根离子与氯离子在酸性条件下发生反应生成氯气.
解答 解:A.向FeI2溶液中滴入过量溴水,碘化亚铁完全被氧化,正确的离子方程式为:2Fe2++4I-+3Br2═2Fe3++2I2+6Br-,故A错误;
B.将Na2O2放入H2O中,反应生成氧气,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故B错误;
C.向NaHSO4溶液中滴入少量Ba(OH)2溶液,反应生成硫酸钡沉淀、硫酸钠和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C错误;
D.将稀盐酸与84消毒液混合,二者反应生成氯气,反应的离子方程式为:C1-+C1O-+2H+═C12↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
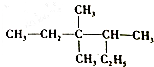
| A. | 2-乙基-3,3-二,甲基戊烷 | |
| B. | 3,3,4-三甲基己烷 | |
| C. | C的价电子轨道表示式:3,3-甲基-4乙基戊烷 | |
| D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
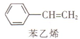
 .
.
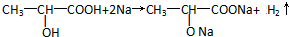 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 离子组 | 要求 |
| A | K+、CO32-、SO42-、Cl- | c(K+)<c(Cl-) |
| B | Na+、CO32-、NO3-、I- | 滴加盐酸立刻有气体生成 |
| C | Mg2+、Cl-、Na+、SO42- | 滴加氨水立刻有沉淀生成 |
| D | NH4+、SO42-、Na+、H+ | 滴加烧碱溶液立刻有气体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 仪器 | 药品 | 实验目的 |
| A | 烧杯、玻璃棒、胶头滴管 | FeCl3溶液、NaOH溶液 | 制Fe(OH)3胶体 |
| B | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的二氧化碳、蒸馏水 | 模拟喷泉实验 |
| C | 酸式滴定管、锥形瓶、铁架台(带铁夹) | 已知浓度的盐酸,待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 酒精灯、玻璃棒、蒸发皿、三脚架 | NaCl溶液 | 蒸发溶液得到晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 中心原子所在族 | ⅣA族 | ⅤA族 | ⅣA族 | ⅥA族 |
| 分子通式 | AB4 | AB3 | AB2 | AB2 |
| 立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
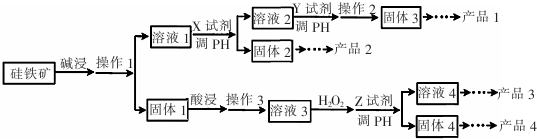
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com