
分析 (1)根据方程式6Li+N2$\frac{\underline{\;点燃\;}}{\;}$2Li3N计算;设反应后Li的质量为xg,Li3N的质量为yg,根据已知数据列方程组计算;
(2)根据n(Li3N)=$\frac{m}{M}$计算,再根据N元素守恒计算氨气的物质的量和体积;根据方程式计算出生成的LiOH的质量,由得到LiOH固体26.56g,可求出溶液中LiOH的质量,再求出溶解度;
(3)含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,生成气体为氢氧化钠吸收是二氧化碳,根据碳元素守恒,可知碱式碳酸钴中的碳酸根离子为0.2mol,根据氯化银的质量判断氯离子全部在溶液中,再根据电荷守恒计算氢氧根离子的物质的量,再由碱式碳酸钴沉淀53.50g、钴元素的质量、碳酸根离子的质量和氢氧根离子的质量求出结晶水的质量和物质的量,然后求出碱式碳酸钴的化学式;
(4)由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2,据此计算CO2的体积分数.
解答 解:(1)设生成的Li3N为xg,
6Li+N2$\frac{\underline{\;点燃\;}}{\;}$2Li3N
6×6.94 2×34.82
4.164g mg
则m=$\frac{2×34.82×4.164g}{6×6.94}$=6.964g;
设反应后Li的质量为xg,Li3N的质量为yg,
则xg+yg=6.840g,xg+yg×$\frac{3×6.94}{34.82}$=4.164g;
解得:x=0.184,y=6.656;
故答案为:6.964;6.656;
(2)已知:Li3N+3H2O→3LiOH+NH3↑,17.41gLi3N的物质的量为n=$\frac{m}{M}$=$\frac{17.41g}{34.82g/mol}$=0.5mol,
由氮元素守恒可知,n(NH3)=0.5mol,则氨气的体积V=nVm=11.2L;
由Li元素守恒可知n(LiOH)=0.5mol×3=1.5mol,则m(LiOH)=nM=1.5mol×23.94g/mol=35.91g,
m(水)=100-1.5mol×18g/mol=73g,
则$\frac{s}{100}$=$\frac{35.91-26.56}{73}$,解得s=12.8g;
故答案为:11.2;12.8g;
(3)反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,则由元素守恒可知该物质为是二氧化碳,其物质的量为$\frac{13.20g}{44g/mol}$=0.3mol,由碳元素守恒可知,碱式碳酸钴中的碳酸根离子为0.2mol;加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,则143.50g是氯化银沉淀,其物质的量为1mol,则氯离子为1mol,又根据钠离子为1mol,则碱式碳酸钴中不含钠元素和氯元素,所以碱式碳酸钴中有钴0.5mol,碳酸根离子为0.2mol,根据电荷守恒,应含氢氧根离子为0.6mol,
碱式碳酸钴中结晶水的质量为:53.50g-0.5mol×58.93g/mol-0.2mol×60g/mol-0.6mol×17g/mol=1.8g,则n(水)=0.1mol,
所以碱式碳酸钴中:钴离子0.5mol,碳酸根离子为0.2mol,氢氧根离子为0.6mol,结晶水0.1mol,
则碱式碳酸钴的化学式:2CoCO3•3Co(OH)2•H2O;
则制备碱式碳酸钴反应的化学方程式:5CoCl2+5Na2CO3+4H2O=2CoCO3•3Co(OH)2•H2O+10NaCl+3CO2↑;
答:碱式碳酸钴的化学式2CoCO3•3Co(OH)2•H2O;制备碱式碳酸钴反应的化学方程式为:5CoCl2+5Na2CO3+4H2O=2CoCO3•3Co(OH)2•H2O+10NaCl+3CO2↑;
(4)由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2;
所以产物气体中CO2的体积分数=$\frac{12mol}{(12+6-3+1.7×\frac{3}{0.21})mol}$=0.305;
答:产物气体中CO2的体积分数为0.305.
点评 本题考查了有关化学方程式的计算,题目难度较大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
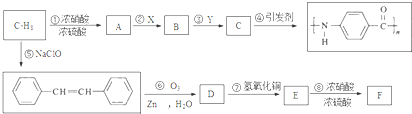
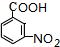 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有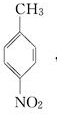 和
和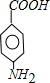 .(填结构简式)
.(填结构简式)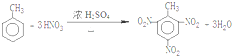 .
.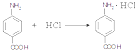 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
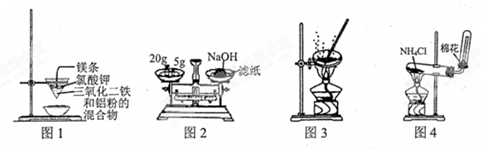
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com