
ЎѕМвДїЎїУГИзНјЛщКѕЧ°ЦГІв¶ЁГѕґшСщЖ·ЦРµҐЦКµДЦКБї·ЦКэЈЁФУЦКУлЛб·ґУ¦І»ІъЙъЖшМеЈ©ЎЈНкіЙПВБРМоїХЈє
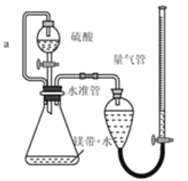
ЈЁ1Ј©УГАлЧУ·ЅіМКЅ±нКѕёГКµСйµД·ґУ¦ФАнЈє____________ЎЈ
ЈЁ2Ј©іЖБїГѕґшЛщРиµД¶ЁБїТЗЖчКЗ _______________ЎЈ
ЈЁ3Ј©БтЛб±ШРл№эБїµДДїµДКЗ_____________ЎЈ
ЈЁ4Ј©µј№ЬaµДЧчУГКЗ ____________ ЎЈ
ЈЁ5Ј©Из№ыІв¶ЁЅб№ыЖ«ёЯЈ¬їЙДЬµДФТтКЗ____________ЎЈЈЁСЎМо±аєЕЈ©
a Ч°ЦГВ©Жш b ОґАдИґЦБКТОВјґ¶БКэ
c ГѕґшЦРє¬УРСх»ЇГѕ dОґ¶БКэК±БїЖш№ЬµДТєГжµНУЪЛ®Чј№Ь
Ўѕґр°ёЎїMg+2H+![]() Mg2++H2
Mg2++H2![]() µзЧУМмЖЅ К№ГѕґшНкИ«·ґУ¦ К№БтЛбЛіАыБчПВЈ¬±ЬГвБтЛбИЬТєµДМе»э¶ФЖшМеµДІв¶ЁІъЙъУ°Пм bd
µзЧУМмЖЅ К№ГѕґшНкИ«·ґУ¦ К№БтЛбЛіАыБчПВЈ¬±ЬГвБтЛбИЬТєµДМе»э¶ФЖшМеµДІв¶ЁІъЙъУ°Пм bd
ЎѕЅвОцЎї
(1)ГѕУлПЎБтЛб·ґУ¦ЙъіЙБтЛбГѕєНЗвЖшЈ»
(2)јЖЛгГѕґшµДЦКБї·ЦКэРиТЄЦЄµАСщЖ·µДЦКБїЈ»
(3)КµСйЦРРиТЄНЁ№эЗвЖшµДОпЦКµДБїЗуµГГѕµДЦКБїЈ¬ЛщТФјУИл№эБїµДБтЛб±ШЈ¬И·±ЈMgНкИ«·ґУ¦Ј»
(4)µј№ЬaїЙЖЅєвЖшС№Ј¬К№·ЦТєВ©¶·ЦРµДБтЛбЛіАыБчПВЈ»
(5)НЁ№эЗвЖшµДОпЦКµДБїЗуµГГѕµДЦКБїЈ¬ґУ¶шЗуіцСщЖ·ЦРГѕµДЦКБї·ЦКэЈ¬ИфІв¶ЁµДЗвЖшМе»эЖ«РЎЈ¬ФтІв¶ЁЅб№ыЖ«µНЈ¬ИфІв¶ЁµДЗвЖшМе»эЖ«ёЯЈ¬ФтІв¶ЁЅб№ыЖ«ёЯЈ¬ѕЭґЛЅшРР·ЦОцЎЈ
(1)ГѕУлПЎБтЛб·ґУ¦ЙъіЙБтЛбГѕєНЗвЖшЈ¬·ґУ¦µДАлЧУ·ґУ¦·ЅіМКЅОЄЈєMg+2H+= Mg2++ H2ЎьЈ»
(2)КµСйЦРІв¶ЁГѕґшСщЖ·ЦРµҐЦКГѕµДЦКБї·ЦКэЈ¬РиТЄѕ«И·іЖБїГѕґшµДЦКБїЈ¬ЛщТФЛщРиµД¶ЁБїТЗЖчµзЧУМмЖЅЈ»
(3)КµСйЦРРиТЄНЁ№эЗвЖшµДОпЦКµДБїЗуµГГѕµДЦКБїЈ¬ґУ¶шЗуіцСщЖ·ЦРГѕµДЦКБї·ЦКэЈ¬ЛщТФјУИлµДБтЛб±ШРл№эБїЈ¬И·±ЈMgНкИ«·ґУ¦Ј»
(4)Лж·ґУ¦µДЅшРРЈ¬Ч¶РОЖїЦРЖшМеФц¶аЈ¬С№ЗїФцґуЈ¬·ЦТєВ©¶·ЦРµДБтЛбІ»ИЭТЧБчПВЈ¬ОЄБЛЖЅєвЖшС№Ј¬УГµј№ЬaЅ«·ЦТєВ©¶·УлЧ¶РОЖїБ¬ЅУЖрАґЈ¬ѕНїЙТФК№БтЛбЛіАыБчПВЈ¬ЛщТФµј№ЬaµДЧчУГКЗЖЅєвЖшС№Ј¬К№БтЛбЛіАыБчПВЈ»
(5)aЈ®Ч°ЦГВ©ЖшЈ¬µјЦВЗвЖшМе»эјхРЎЈ¬Ів¶ЁЅб№ыЖ«µНЈ¬№КaґнОуЈ»
bЈ®ОґАдИґЦБКТОВјґ¶БКэЈ¬ёщѕЭИИХНАдЛхФАнїЙЦЄЈ¬Ів¶ЁµДЗвЖшМе»эЖ«ґуЈ¬Ів¶ЁЅб№ыЖ«ёЯЈ¬№КbХэИ·Ј»
cЈ®ГѕґшЦРє¬УРСх»ЇГѕЈ¬ІъЙъµДЗвЖшМе»эЖ«РЎЈ¬Ів¶ЁЅб№ыЖ«µНЈ¬№КcґнОуЈ»
dЈ®Д©¶БКэК±БїЖш№ЬµДТєГжµНУЪЛ®Чј№ЬЈ¬µјЦВ¶БіцМе»эЖ«ґуЈ¬Ів¶ЁЅб№ыЖ«ёЯЈ¬№КdХэИ·Ј»
№Кґр°ёОЄЈєbdЎЈ


 µЪ1ѕнµҐФЄФВїјЖЪЦРЖЪД©ПµБРґр°ё
µЪ1ѕнµҐФЄФВїјЖЪЦРЖЪД©ПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»¶ЁОВ¶ИПВЈ¬ФЪ3ёцМе»эѕщОЄ1.0LµДєгИЭГЬ±ХИЭЖчЦР·ґУ¦2H2(g)+CO(g)![]() CH3OH(g)ґпµЅЖЅєвЎЈПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©
CH3OH(g)ґпµЅЖЅєвЎЈПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©
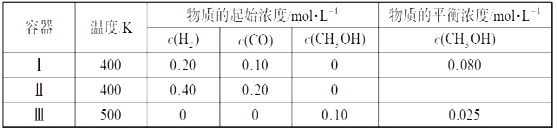
A.ґпµЅЖЅєвК±Ј¬ИЭЖчўсЦР·ґУ¦ОпЧЄ»ЇВК±ИИЭЖчўтЦРµДґу
B.ёГ·ґУ¦µДХэ·ґУ¦·ЕИИ
C.ґпµЅЖЅєвК±Ј¬ИЭЖчўтЦРc(H2)ґуУЪИЭЖчўуЦРc(H2)µДБЅ±¶
D.ґпµЅЖЅєвК±Ј¬ИЭЖчўуЦРµДХэ·ґУ¦ЛЩВК±ИИЭЖчўсЦРµДРЎ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїіЈОВПВЈ¬Ії·ЦЛбµДµзАлЖЅєвіЈКэИзПВЈє
»ЇС§КЅ | HF | HCN | H2CO3 |
µзАліЈКэ | KaЈЅ3.5ЎБ10©Ѓ4 | KaЈЅ5.0ЎБ10©Ѓ10 | Ka1ЈЅ4.3ЎБ10©Ѓ7Ј¬ Ka2ЈЅ5.6ЎБ10©Ѓ11 |
ЈЁ1Ј©c(H+)ПаН¬µДИэЦЦЛбЈ¬ЖдЛбµДЕЁ¶ИґУґуµЅРЎОЄ________________ЎЈ
ЈЁ2Ј©0.0lmol/LµДHCNИЬТєЦРЈ¬c(H+)ФјОЄ_____mol/LЎЈК№ґЛИЬТєЦРHCNµДµзАліМ¶ИФцґуЗТc(H+)ТІФцґуµД·Ѕ·ЁКЗ_______________________ЎЈ
ЈЁ3Ј©ЦРєНµИБїµДNaOHЈ¬ПыєДµИpHµДЗв·ъЛбєНБтЛбµДМе»э·Ц±рОЄaLЎўbLЈ¬Фтa_____bЈЁМоЎ°ґуУЪЎ±ЎўЎ°РЎУЪЎ±»тЎ°µИУЪЎ±Ј¬ПВН¬Ј©bЎЈЦРєНµИЕЁ¶ИЎўµИМе»эµДЗв·ъЛбєНБтЛбРиТЄNaOHµДОпЦКµДБїОЄn1Ўўn2Ј¬Фтn1_____n2ЎЈ
ЈЁ4Ј©ПтNaCNЦРНЁИлЙЩБїµДCO2Ј¬·ўЙъµДАлЧУ·ЅіМКЅОЄ_______________ЎЈ
ЈЁ5Ј©ЙијЖКµСйЦ¤ГчЗв·ъЛб±ИСОЛбµДЛбРФИх__________________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБР·ґУ¦ЦРЈ¬КфУЪИЎґъ·ґУ¦µДКЗ
ўЩCH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
ўЪCH3CH2OH![]() CH2CH2+H2O
CH2CH2+H2O
ўЫCH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
ўЬC6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A.ўЩўЪB.ўЫўЬC.ўЩўЫD.ўЪўЬ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїёщѕЭПВБРНјКѕЛщµГіцµДЅбВЫХэИ·µДКЗ
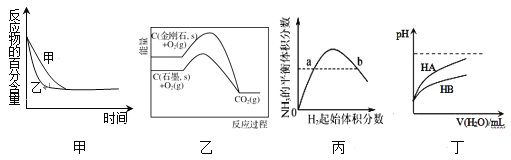
A.НјјЧ±нКѕС№Зї¶ФїЙДж·ґУ¦2A(g)+2B(g)![]() 3C(g)+D(s)µДУ°ПмЈ¬ТТµДС№Зї±ИјЧµДС№Зїґу
3C(g)+D(s)µДУ°ПмЈ¬ТТµДС№Зї±ИјЧµДС№Зїґу
B.НјТТКЗЅрёХКЇУлКЇД«·Ц±рСх»ЇЙъіЙCO2µДДЬБї№ШПµЗъПЯЈ¬ЛµГчКЇД«ЧЄ»ЇОЄЅрёХКЇµД·ґУ¦µД¦¤H>0
C.Нј±ы±нКѕТ»¶ЁМхјюПВµДєПіЙ°±·ґУ¦ЦРЈ¬NH3µДЖЅєвМе»э·ЦКэЛжH2ЖрКјМе»э·ЦКэ(N2µДЖрКјБїєг¶Ё)µД±д»ЇЈ¬НјЦРaµгN2µДЧЄ»ЇВКґуУЪbµг
D.Нј¶Ў±нКѕіЈОВПВЈ¬ПЎКНHAЎўHBБЅЦЦЛбµДПЎИЬТєК±Ј¬ИЬТєpHЛжјУЛ®БїµД±д»ЇЈ¬ФтПаН¬МхјюПВNaAИЬТєµДpHґуУЪН¬ЕЁ¶ИµДNaBИЬТєµДpH
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТТЛбТТхҐ№г·єґжФЪУЪТ©ОпЎўИѕБПЎўПгБПµИ№¤ТµЈ¬ЦРС§»ЇС§КµСйіЈУГЧ°ЦГАґЦЖ±ёЈє
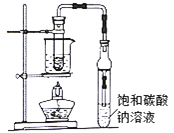
НкіЙПВБРМоїХЈє
(1)РґіцКµСйКТЦЖ±ёТТЛбТТхҐµД»ЇС§·ЅіМКЅЈє_______НЁіЈјУИл№эБїТТґјЈ¬ФТтКЗ_______
(2)±ҐєНМјЛбДЖИЬТєµДЧчУГКЗўЩ__________ўЪ__________
(3)ИфУГЧ°ЦГЦЖ±ёТТЛбТТхҐЈ¬ЖдИ±µгУР_________Ўў_________ЎЈ±Я·ґУ¦±ЯНЁ№э·ЦТєВ©¶·±ЯµОјУТТЛбЈ¬±ЯјУИИХфіцТТЛбТТхҐЎЈХвСщІЩЧчїЙТФМбёЯхҐµДІъВКЎЈЖдФТтКЗ______
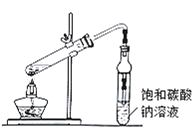
(4)ПЦДв·ЦАлґЦІъЖ·ТТЛбТТхҐЎўТТЛбєНТТґјµД»мєПОпЎЈПВБРїтНјКЗ·ЦАлІЩЧчІЅЦиБчіМНјЈє
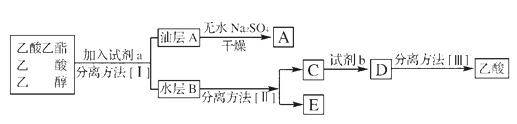
·ЦАл·Ѕ·ЁIIКЗ____________КФјБbКЗ____________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї250CК±Ј¬Пт20.0mL0.10mol/L°±Л®ЦРµОИл0.10mol/LСОЛбЈ¬ИЬТєµДpHУлЛщјУСОЛбµДМе»э№ШПµИзНјЛщКѕЎЈТСЦЄ0.10mol/L°±Л®µДµзАл¶ИОЄ1.32%Ј¬ПВБРУР№ШРрКцІ»ХэИ·µДКЗЈЁ Ј©
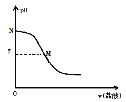
A.±ѕКµСйУ¦СЎУГµДЦёКѕјБКЗјЧ»щіИ
B.Mµгґ¦µДИЬТєЦРc(NH4+)=c(Cl)>c(H+)=c(OH)
C.Nµгґ¦µДИЬТєЦРpH<12
D.Mµг¶ФУ¦µДСОЛбМе»эОЄ20.0mL
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїМъЎўГѕЎўВБИэЦЦЅрКф·Ц±рєНН¬Ме»эН¬ЕЁ¶ИµДСОЛб·ґУ¦Ј¬Н¬ОВН¬С№ПВЈ¬ІъЙъПаН¬Ме»эµДЗвЖшЈ¬ФтІОјУ·ґУ¦µДЅрКф ЈЁ Ј©
A.ЛщК§ИҐµДµзЧУКэПаµИB.ІОјУ·ґУ¦µДЅрКфЦКБїПаµИ
C.ІОјУ·ґУ¦µДЅрКфОпЦКµДБїПаН¬D.МъЎўГѕЎўВБµДЦКБї±ИОЄ56Јє24Јє27
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДЗїЙ¶ЎКЗТ»ЦЦТ©ОпЈ¬ОЄЦ§Жш№ЬЅвѕ·РФХтїИТ©Ј¬ДЬЅвіэЦ§Жш№ЬЖЅ»¬јЎѕ·ВОЈ¬ТЦЦЖ·ОЗЈХЕ·ґЙдТэЖрµДїИЛФЈ¬»ЇєПОпHКЗЦЖ±ёёГТ©ОпµДЦШТЄЦРјдМеЈ¬єПіЙВ·ПЯИзНјЈє
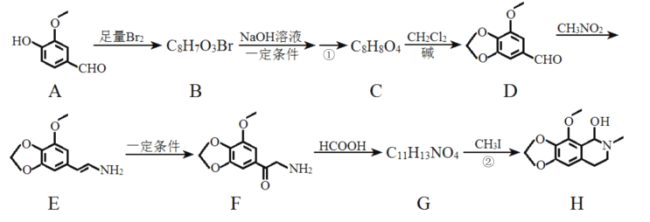
ТСЦЄЈє
a.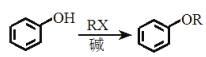 Ј»
Ј»
b.RNH2![]() RNHCH3ЎЈ
RNHCH3ЎЈ
ЈЁ1Ј©·ґУ¦ўЩµДМхјюОЄ__ЎЈ
ЈЁ2Ј©·ґУ¦ўЪµД·ґУ¦АаРНОЄ__ЎЈ
ЈЁ3Ј©»ЇєПОпGµДЅб№№јтКЅОЄ__ЎЈ
ЈЁ4Ј©ПВБРЛµ·ЁХэИ·µДКЗ__ЎЈ
aЈ®ОпЦКDДЬУлFeCl3·ўЙъПФЙ«·ґУ¦
bЈ®ОпЦКFѕЯУРјоРФ
cЈ®ОпЦКGДЬєНТш°±ИЬТє·ўЙъ·ґУ¦
dЈ®ОпЦКHµД·ЦЧУКЅКЗC12H15NO4
ЈЁ5Ј©РґіцCЎъDµД»ЇС§·ЅіМКЅЈє__ЎЈ
ЈЁ6Ј©ВъЧгПВБРМхјюЈ¬»ЇєПОпAЛщУРН¬·ЦТм№№МеУР__ЦЦЈЁІ»°ьАЁAЈ©ЎЈ
ўЩїЙТФУл»оІЁЅрКф·ґУ¦ЙъіЙЗвЖшЈ¬µ«І»УлNaHCO3ИЬТє·ґУ¦Ј»
ўЪ·ЦЧУЦРє¬УР![]() Ѕб№№Ј»
Ѕб№№Ј»
ўЫє¬УР±Ѕ»·Ј¬ЗТУРБЅёцИЎґъ»щЎЈ
ЈЁ7Ј©ТСЦЄCH2=CHCH3![]() CH2=CHCH2ClЈ¬ЗлТФ
CH2=CHCH2ClЈ¬ЗлТФ![]() ЎўCH3CHClCH3ОЄФБПєПіЙ»ЇєПОп
ЎўCH3CHClCH3ОЄФБПєПіЙ»ЇєПОп Ј¬РґіцЦЖ±ёµДєПіЙВ·ПЯБчіМНјЈЁОЮ»ъКФјБИОСЎЈ©__ЎЈ
Ј¬РґіцЦЖ±ёµДєПіЙВ·ПЯБчіМНјЈЁОЮ»ъКФјБИОСЎЈ©__ЎЈ
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com