



科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、NaHSO4 |
| C、FeSO4 |
| D、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2So4 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
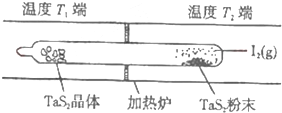 (1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了
(1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了| n |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2为0.3mol/L |
| B、Y为0.65mol/L |
| C、Y2为0.2mol/L |
| D、Z为0.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂或方法 | 化学方程式 | |
| Mg(Al) | ||
| CO(CO2) | ||
| Na2CO3粉未 (NaHCO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com