
| A. | 纸上层析法 | B. | 萃取分液法 | C. | 结晶法 | D. | 蒸馏法 |
科目:高中化学 来源: 题型:选择题
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
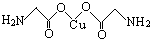
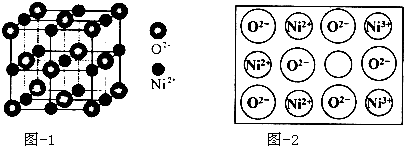
 GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.
GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
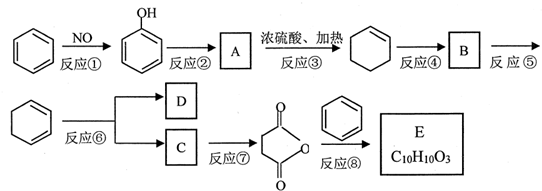
 +(CH3CO)2O→
+(CH3CO)2O→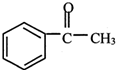 +CH3COOH
+CH3COOH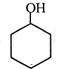 ; B
; B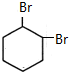
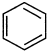 直接制取
直接制取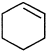 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.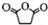 +
+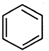 →
→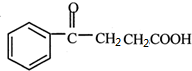 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com