
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、某些复分解(如铵盐和强碱)和碳、一氧化碳、氢气等还原金属氧化物;
有化合价变化的反应为氧化还原反应,据此分析判断.
解答 解:①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反应,属于常见的吸热反应;
②燃烧木炭取暖是物质的燃烧,放出热量,属于常见的放热反应,有化合价变化,则属于氧化还原反应;
③炸药爆炸要放出热量,属于放热反应,有化合价变化,则属于氧化还原反应;
④酸与碱的中和反应要放热热量,属于常见的放热反应,没有化合价变化,则不属于氧化还原反应;
⑤食物因氧化而腐败要放热热量,属于放热反应,有氧气参与,化合价发生变化,则属于氧化还原反应;
故答案为:②③④⑤;①;②③⑤.
点评 本题考查吸热反应、放热反应,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:解答题
 化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例.在250mL圆底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解.滴入4〜6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图):
化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例.在250mL圆底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解.滴入4〜6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
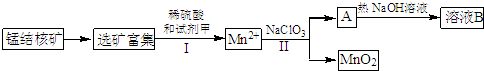
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
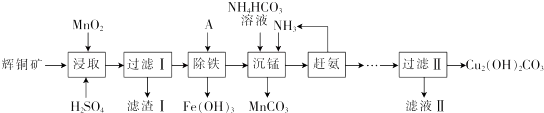
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 固体成分 | 气体成分 | |
| A | Na2CO3 | CO2、H2O、O2 |
| B | Na2CO3 | H2O、O2 |
| C | Na2CO3、Na2O2 | O2 |
| D | Na2CO3、Na2O2、NaOH | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
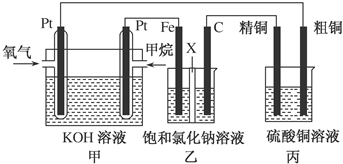
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镍做催化剂的条件下,苯与氢气反应 | |
| B. | 苯与液溴混合后加入铁粉 | |
| C. | 乙烯通入溴水中 | |
| D. | 烧至红热的铜丝插入乙醇中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | M | N | P | Q |
| 反应前质量(g) | 15.8 | 8.4 | 31.6 | 1.6 |
| 一段时间后质量(g) | 待测 | 14 | 21.6 | 6 |
| A. | 该反应类型属置换反应 | B. | 物质P一定是化合物 | ||
| C. | 反应生成的N与Q的质量比为7:3 | D. | M肯定为该反应的催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com