
| A. | 反应开始前,检查装置的气密性 | |
| B. | 加入过量稀硫酸,以确保镁带完全反应 | |
| C. | 反应停止后,立即调压并记录读数 | |
| D. | 常温下1mol氢气的体积为$\frac{V({H}_{2})}{m(Mg)}$×M(Mg) |
分析 A.实验前需要检验装置气密性,防止装置漏气;
B.硫酸过量可以使镁完全反应;
C.反应放热,应降低温度再调压读取氢气体积;
D.根据n=$\frac{m}{M}$计算物质的量,根据Vm=$\frac{V}{n}$计算1mol气体的体积.
解答 解:A.实验需要测定生成氢气的体积,实验前需要检验装置气密性,防止装置漏气,故A正确;
B.加入过量的硫酸,可以使是镁完全反应,故B正确;
C.反应放热,气体具有热胀冷缩性质,应降低温度到室温再调压读取氢气体积,故C错误;
D.根据n=$\frac{m}{M}$可知Mg的物质的量为$\frac{m(Mg)}{M(Mg)}$,则1mol气体的体积为$\frac{V(HCl)}{\frac{m(Mg)}{M(Mg)}}$=$\frac{V({H}_{2})}{m(Mg)}$×M(Mg),故D正确,
故选:C.
点评 本题考查定量测定实验,明确原理是关键,注意读取氢气体积时应降低温度到室温,再调节压强.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
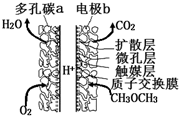 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
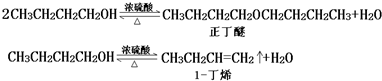
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
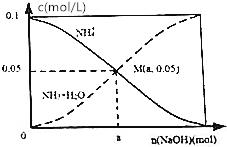 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com