
| A、MgCl2?7H2O |
| B、MgCl2?2H2O |
| C、MgCl2?6H2O |
| D、MgCl2?5H2O |
| 19g |
| 95 |
| 21.6 |
| 18 |


科目:高中化学 来源: 题型:
| A、1mol羟基的电子数目为10NA |
| B、常温,32g氧气和臭氧的混合物含氧原子素数共2NA |
| C、标准状况下,11.2L的HF所含的分子数为0.5NA |
| D、2mol Na2O2与足量的水反应转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
| B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | SO2有还原性 | 用SO2可使溴水褪色 |
| D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的化合物的晶体类型与M、T形成的化合物的晶体类型相同 |
| B、工业生产中L、M的单质均用电解其熔融盐的方法冶炼而得 |
| C、相同条件下,等物质的量的单质与氢气化合放出能量:T>Q |
| D、离子半径:Q2->T2->L2+>M3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol O2和N2混合气体的体积约为22.4L |
| B、1mol气体的体积约为22.4L |
| C、1mol酒精在标准状况下的体积约为22.4L |
| D、22.4L气体所含分子数一定大于11.2L气体所含的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若有固体剩余,则剩余固体一定是Cu |
| B、若有固体剩余,则溶液中一定不含Fe3+和Cu2+ |
| C、若无固体剩余,则溶液中一定有Cu2+和Fe2+ |
| D、若无固体剩余,则溶液中一定有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、量筒 | B、酸式滴定管 |
| C、碱式滴定管 | D、容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
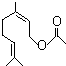 下列关于该物质的说法正确的是( )
下列关于该物质的说法正确的是( )| A、分子式是C11H18O2 |
| B、1 mol乙酸橙花酯跟H2反应,最多消耗2 mol H2 |
| C、1 mol乙酸橙花酯跟NaOH溶液反应,最多消耗2 mol NaOH |
| D、乙酸橙花酯的一种同分异构体可能是酚类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com