
【题目】已知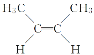 与
与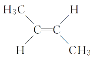 是互为“顺反异构”的同分异构体,有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
是互为“顺反异构”的同分异构体,有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
A.C4H8可能是烯烃
B.C4H8中属于烯烃的同分异构体有4种(含顺反异构)
C.C4H8中属于烯烃的顺反异构体有2种
D.核磁共振氢谱有2种吸收峰的烯烃结构一定是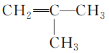
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。

(1)上述元素中,原子中未成对电子数最多的是 ___________ (填字母),写出该元素基态原子的核外电子排布式: ___________ 。
(2)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4562 | 1820 |
I3 | 11799 | 6912 | 2750 |
I4 | 9543 | 11600 |
①表中X可能为以上13种元素中的 _____________ (填字母)元素。用元素符号表示X和j形成的一种化合物的化学式: _____________ 。
②Y是周期表中第 _____________ 族元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用。
(1)C、N、O三种元素的第一电离能由大到小的顺序为__。
(2)与N3-含有相同电子数的三原子微粒的空间构型是__。
(3)Cu+的电子排布式为__,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O:__。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__,乙醛分子H-C-O的键角_(填“大于”“等于”或“小于”)乙醇分子中的H-C-O的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出Cu(H2O)2Cl2具有极性的分子的结构式:___。
(6)Cu3N的晶胞结构如图所示,N3-的配位数为__,Cu+的半径为apm,N3-的半径为bpm,Cu3N的密度为__g·cm-3(阿伏加德罗常数用NA表示)。
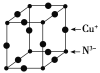
(7)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是__;
(8)发射神舟飞船的长征火箭用肼(N2H4,气态)为燃料,为了提高肼(N2H4)燃烧过程中释放的能量,常用NO2作氧化剂代替O2,这两者反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1,写出肼和NO2完全反应的热化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用铜、锌的国家,铜、锌及其化合物在日生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位于 _____(选填“s” “p” “d”或“ds” )区。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因______________。
(2)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为________,1mol
中C和N原子的杂化均为________,1mol![]() 含有_____molσ键。
含有_____molσ键。
②双吡咯铜Cu(![]() )2中含有的化学键有_____(填编号)。
)2中含有的化学键有_____(填编号)。
A 金属键 B 极性键 C 非极性键 D 配位键 E 氢键
③噻吩(![]() )的沸点为84℃,吡咯(
)的沸点为84℃,吡咯( ![]() )的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
)的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
④分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大![]() 键原子数,n 代表参与形成的大
键原子数,n 代表参与形成的大![]() 键电子数(如苯分子中的大
键电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_______。
键应表示为_______。
(3)硼氢化锌[Zn ( BH4 )2 ]常用作有机合成中的还原剂,BH4-的VSEPR模型为______,与其互为等电子体的分子和阳离子有______(各写一种)。
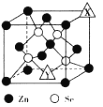
(4)硒化锌(ZnSe)是一种半导体材料,其晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为 _____(填“立方体”、 “正四面体”或“正八面体” ) ;若该晶胞的参数为a pm, NA代表阿伏加德罗常数的数值,则晶胞的密度为_____ gcm-3(用相关字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是( )
已知事实 | 推论 | |
A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯),反应原理: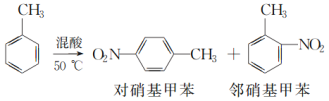
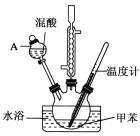
实验步骤:①浓硝酸与浓硫酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈烧瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈烧瓶中加入混酸;
④控制温度约为50~55℃,反应大约10min,三颈烧瓶底部有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
有机物 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)A的仪器名称是___。
(2)水浴加热的优点是__。
(3)配制混酸的方法是__。
(4)若实验后在三颈烧瓶中收集的产物较少,可能的原因是__。
(5)分离反应后产物的方案如下:
混合液![]()
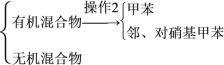
操作1的名称是__,操作2中不需要用到下列仪器中的__(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为__(结果保留至小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示错误的是
A.氮原子价层电子的轨道表示式:![]()
B.Cu2+基态核外电子排布式:1s22s22p63s23p63d9
C.HF分子间氢键示意图: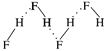
D.乙腈(CH3CN)的结构式:CH3-C≡N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙 66 具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应 用于汽车、电气等工业中。以下是生产尼龙 66 的一些途径。
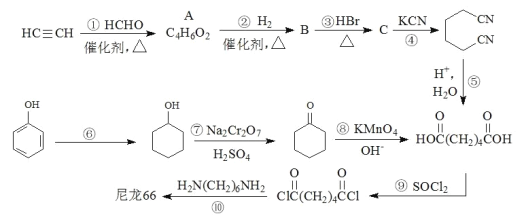
已知:连接在 C≡C 碳原子上的氢原子比较活泼,在催化剂作用下碳氢键易断裂。
(1)A 的结构简式为__________________________。
(2)B 中官能团的名称是__________________________。
(3)反应①~④中,属于加成反应的有__________________________,反应⑥~⑨中,属于氧化反应的有__________________________。
(4)请写出反应⑥的化学方程式__________________________。
(5)高分子材料尼龙 66 中含有![]() 结构片段,请写出反应⑩的化学方程式_____________________。
结构片段,请写出反应⑩的化学方程式_____________________。
(6)某聚合物 K 的单体与 A 互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为 1:2:3,且 能与 NaHCO3 溶液反应,则聚合物 K 的结构简式是__________________________。
(7)聚乳酸(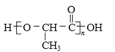 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应:![]() (R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
(R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,2元素可形成负一价离子。下列说法正确的是( )
,2元素可形成负一价离子。下列说法正确的是( )
A.X元素基态原子的电子排布式为![]()
B.X元素是第4周期第VA族元素
C.Y元素原子的轨道表示式为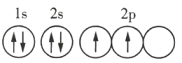
D.Z元素的单质Z2在氧气中不能燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com