
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
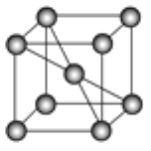
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
【答案】 1s22s22p63s23p63d5或[Ar]3d5 Fe3+的3d轨道填充了5个电子,为半充满状态 10 N2 CN- 2 ![]()
【解析】试题分析:本题考查离子核外电子排布式的书写、σ键的计算、等电子体的书写、晶胞的分析和计算。
(1)Fe原子核外有26个电子,基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,Fe3+的电子排布式为1s22s22p63s23p63d5。Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6,Fe3+的3d轨道填充了5个电子,为半充满状态,较稳定,Fe3+的化学性质比Fe2+稳定。
(2)CO的结构式为C![]() O,1个CO分子中含1个σ键,1个Fe与5个CO形成5个配位键,配位键也是σ键,1个Fe(CO)5中含有10个σ键,1molFe(CO)5中含有10molσ键。
O,1个CO分子中含1个σ键,1个Fe与5个CO形成5个配位键,配位键也是σ键,1个Fe(CO)5中含有10个σ键,1molFe(CO)5中含有10molσ键。
(3)用替代法,与CO互为等电子体的分子为N2,离子有CN-、C22-等。
(4)①用“均摊法”,该晶胞中含有的铁原子数:8![]() +1=2个。
+1=2个。
②晶胞的体积为a3cm3,1mol晶体的体积为![]() NAcm3,1mol晶体的质量为56g,晶体铁的密度为56g
NAcm3,1mol晶体的质量为56g,晶体铁的密度为56g![]() (
(![]() NAcm3)=
NAcm3)=![]() g/cm3。
g/cm3。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:

实验数据可发现有一个数据明显有错误,该数据是实验________(填实验序号),理由是_______________________________________________
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是___________。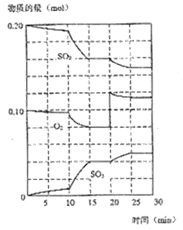
(2)据图判断,反应进行至20min时,曲线发生变化的原因是__________(用文字表达);10min到15min的曲线变化的原因可能是_____________(填写编号)。
A. 加了催化剂 B. 缩小容器体积
C. 降低温度 D. 增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系: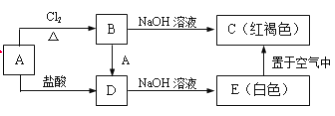
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的下列性质能肯定该物质为离子化合物的是( )
A.水溶液能导电的化合物
B.由金属元素和非金属元素组成的化合物
C.在熔化状态下能导电的化合物
D.熔点高的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. 一个苯分子含3个π键和6个σ键
B. 金属的导电性、导热性、延展性都与自由电子有关
C. C2H2分子中σ键与π键的数目比为1∶1
D. 水加热到很高温度都难分解是因水分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂为了节能减排,将烟道气中SO2和含Ca(OH)2、NaOH的废碱液作用,经过一系列化学变化,最终得到石膏和过二硫酸钠(Na2S2O8)。设计简要流程如图:
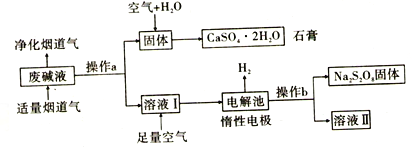
(1)操作a的名称是____________________。废碱液经操作a得到的固体为___________(填化学式)。
(2)向溶液I中通入足量的空气发生反应的化学方程式为_____________________________。
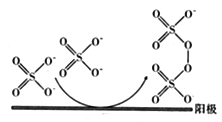
(3)已知用惰性电极电解SO42-可生成S2O82-,其过程如下图所示,S2O82-中S的化合价为__________,阳极生成Na2S2O8的电极反应式为____________________________;在整个流程中可以循环利用的物质是H2O和_________________ (填化学式)。
(4)若制取1mol Na2S2O8且阳极有11.2L的氧气产生(标准状况)。则电解生成的H2在标准状况下的体积为______________L。
(5)烟道气中的SO2可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1 (H2SO3)=1.8×10-2,Ka2 (H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学。下列是中学化学中一些常见的实验装置,按要求回答下列问题:
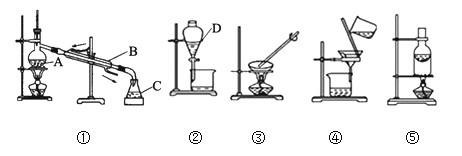
(1)写出仪器名称:D__________。
(2)装置①中的错误是_______________________________。
(3)分离下列混合物的实验操作中,用到实验装置②的是______,用到装置⑤的是________(填字母代号)。
A.水和泥沙的混合物 B.水和酒精的混合物
C.水和四氯化碳的混合物 D.淀粉胶体和氯化钠溶液
E.固体氯化钠和碘单质 F.碳酸钙和碳酸钠粉末
(4)粗盐提纯所需装置为_________和___________,操作过程中均要用到玻璃棒,玻璃棒的作用分别是________________、_________________。
(5)装置②可用于CCl4萃取碘水中的碘,如何检验萃取后的碘水中还存在碘单质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中,不利于实现让海南“天更蓝,山更绿,水更清”目标的是( )
A.污水未经处理直接排入大海B.推广使用清洁能源
C.植树进林,提高森林覆盖率D.推广使用无磷洗涤剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号_____________。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式___________________。
③画出甲元素的原子结构示意图_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com