
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
分析 A.光导纤维的成分为二氧化硅,对光具有良好的全反射作用;
B.温度可使蛋白质发生变性;
C.氯气与纯碱反应,且密度比空气密度大;
D.乙醇能被酸性重铬酸钾氧化.
解答 解:A.光导纤维的成分为二氧化硅,对光具有良好的全反射作用,则是一种很好的通讯材料,但不导电,故A错误;
B.温度可使蛋白质发生变性,则为了防止蛋白质变性,疫苗等生物制剂应冷冻保藏,故B错误;
C.氯气与纯碱反应,且密度比空气密度大,则氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移,故C正确;
D.乙醇能被酸性重铬酸钾氧化,与乙醇的还原性有关,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:HCO3-、NO3-、Na+、NH4+ | |
| B. | pH=7溶液中:Fe3+、K+、SO42-、NO3- | |
| C. | 加入铝粉能产生H2的溶液:NH4+、K+、CO32-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol?L-1的溶液中:Na+、K+、SiO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是制造飞机的理想材料 | B. | 它的主要组成元素是碳元素 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 营养成分 | 钙 | 磷 | 铁 | 锌 |
| 含量(mg/100g) | 600 | 520 | 6~11 | 3~7 |
| A. | 金属 | B. | 非金属 | C. | 元素 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
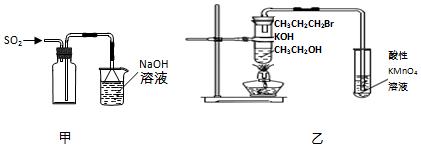
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com