
| A. | 加热NH4Cl | B. | 干冰汽化 | C. | HCl溶于水 | D. | NaOH固体熔化 |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn和浓H2SO4 | B. | C和浓HNO3 | ||
| C. | Cu和浓HNO3 | D. | Na2O2和NH4Cl浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
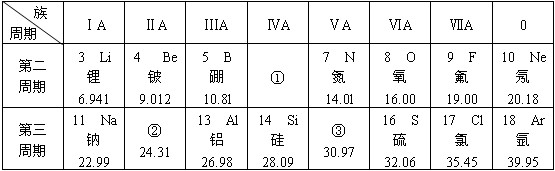
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液反应:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸钙与足量盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→BrCH2-CH2Br | |
| D. | 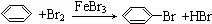 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
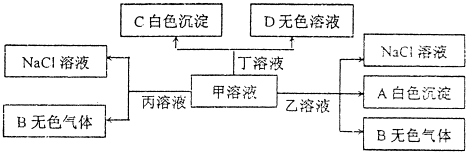
| A. | 乙为AlC13 | |
| B. | 能大量共存于溶液丙中的离子:Fe3+、SO42-、NO3- | |
| C. | 甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 甲溶液中滴加少量丁溶液反应的离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是天然高分子化合物 | |
| B. | 蔗糖和麦芽糖互为同分异构体 | |
| C. | 蛋白质溶液中加入Na2SO4可使其变性 | |
| D. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
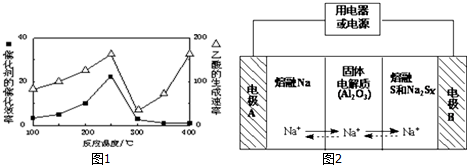
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com