
| A. | 恒温条件下向水中加入少量Na2SO4固体 | |
| B. | 将水加热煮沸 | |
| C. | 恒温条件下向水中通入SO2气体 | |
| D. | 恒温条件下向水中通入氨气 |
分析 水为弱电解质,水的电离平衡为:H2O?H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,电离过程为吸热过程,加热促进电离平衡正向进行.
解答 解:A.恒温条件下向水中加入少量Na2SO4固体,软件后溶液为中性,不影响水的电离,故A正确;
B.加热促进水的电离平衡正向进行,影响电离平衡,故B错误;
C.恒温条件下向水中通入SO2气体,二氧化硫和水反应生成亚硫酸,抑制水的电离,故C错误;
D.恒温条件下向水中通入氨气,氨气和水反应生成的一水合氨为弱碱抑制水的电离,故D错误;
故选A.
点评 本题考查了水的电离,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,根据溶液中氢离子和氢氧根离子浓度是否变化来确定是否破坏水的电离,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42- | |
| B. | 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
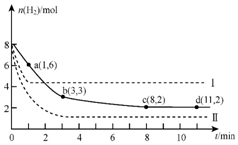 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ查看答案和解析>>
科目:高中化学 来源: 题型:填空题
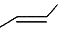 .有机物X的键线式为
.有机物X的键线式为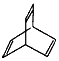
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.26% | B. | -5.26% | C. | 5% | D. | -5% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
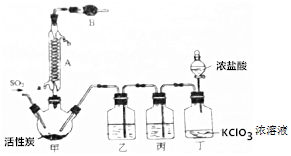
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把色彩鲜艳的着色剂添加到婴幼儿食品中 | |
| B. | 做菜时用适量的食盐、味精和醋调味 | |
| C. | 把发霉的大米晒干并淘洗干净后做成甜酒上市销售 | |
| D. | 把过期食品下架回收,重新喷码后再上架销售 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com