
| A. |  | B. |  | C. |  | D. | 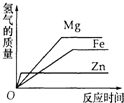 |
分析 等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,只有氢离子得电子生成氢气,根据原子守恒得到生成氢气质量相等,因为金属活泼性不同导致反应速率不同,金属活泼性越强,其反应速率越大导致反应时间越短,据此分析解答.
解答 解:等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,只有氢离子得电子生成氢气,根据原子守恒得到生成氢气质量相等,因为金属活泼性不同导致反应速率不同,金属活泼性越强,其反应速率越大导致反应时间越短,金属活泼性Mg>Zn>Fe,所以反应速率大小顺序是Mg>Zn>Fe,则反应时间大小顺序是Fe>Zn>Mg,故选B.
点评 本题考查根据化学方程式进行计算,正确判断哪种物质足量是解本题关键,根据原子守恒判断生成气体质量,影响物质反应速率的主要因素是物质本身性质,外界条件只是影响因素,题目难度不大.


科目:高中化学 来源: 题型:解答题
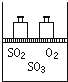 如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:
如图,将4mol SO2和2mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.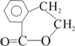 E
E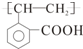 ;
;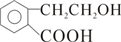 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O
+2H2O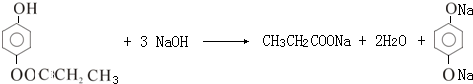 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的 Ksp约等于2.46×10-6 | |
| D. | 向只含有Ca(OH)2 和Mg(OH)2]两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$比值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金 | B. | 银 | C. | 铜 | D. | 钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com