
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+bB(g)⇌3C(g)+2D(g)△H<0; 4min时甲容器内的反应恰好达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L; t min时乙容器内的反应达平衡,根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)= ,化学方程式中计量数b= .
(2)乙容器中反应达到平衡时所需时间t 4min(填“大于”、“小于”或“等于”).
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是AC.
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(4)写出平衡常数表达式K= ,并计算在T℃时的化学平衡常数K .
考点: 反应速率的定量表示方法;化学平衡的影响因素.
专题: 化学平衡专题.
分析: (1)根据v=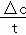 计算反应速率,根据速率之比等于计量数之比确定b的值;
计算反应速率,根据速率之比等于计量数之比确定b的值;
(2)根据影响化学反应速率的因素判断;
(3)根据等效平衡的条件判断;
(4)根据平衡常数的定义书写表达式,并进行计算;
解答: 解:(1)起始时A、B的浓度分别为6mol/L和3mol/L,达到平衡时,A、B的浓度分别为2.4mol/L和1.8mol/L,根据v=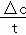 可知,A的反应速率为
可知,A的反应速率为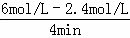 =0.9mol/(L•min),B的反应速率为
=0.9mol/(L•min),B的反应速率为 =0.3mol/(L•min),根据速率之比等于计量数之比可得3:b=3:1,所以b=1,故答案为:0.3mol/(L•min);1;
=0.3mol/(L•min),根据速率之比等于计量数之比可得3:b=3:1,所以b=1,故答案为:0.3mol/(L•min);1;
(2)乙容器的体积大于甲容器,所以甲容器中压强大于乙,所以反应速率快,乙容器中反应达到平衡时所需时间t>4min,故答案为:大于;
(3)要使甲、乙容器中B的平衡浓度相等,即使它们成为等效平衡,
A.保持温度不变,增大甲容器的体积至2L,则起始状态和乙容器一样,所以它们平衡时各成分的浓度也一样,故A正确;
B.在改变条件前,甲容器中B的浓度大于乙容器,由于该反应是放热反应,使甲容器升高温度,平衡逆向移动,甲容器中B的浓度更大,故B错误;
C.在改变条件前,甲容器中B的浓度大于乙容器,保持容器压强和温度都不变,向甲中加入一定量的A气体,平衡正向移动,B的浓度减小,有可能和乙容器中B的浓度相等,故C正确;
D.在改变条件前,甲容器中B的浓度大于乙容器,保持容器压强和温度都不变,向甲中加入一定量的B气体,则甲容器中B的浓度更大,所以D错误;
故选AC;
(4)平衡常数等于生成物浓度的系数次幂之积除以反应物浓度的系数次幂之积,所以K=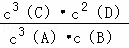 ,在甲容器中,平衡时反应用去的A的浓度为3.6mol/L,根据化学方程式可知,平衡时C的浓度为3.6mol/L,D的浓度为2.4mol/L,所以K=
,在甲容器中,平衡时反应用去的A的浓度为3.6mol/L,根据化学方程式可知,平衡时C的浓度为3.6mol/L,D的浓度为2.4mol/L,所以K= =10.8mol/L,故答案为:
=10.8mol/L,故答案为: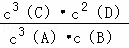 ;10.8mol/L;
;10.8mol/L;
点评: 本题主要考查了化学反应速率的计算、化学反应速率之比等于计量数之比、影响化学反应速率的因素、等效平衡等知识点,中等难度,解题时注意基本概念和基本公式的灵活运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H﹣H,H﹣O和O=O键的键焓△H分别为436kJ•mol﹣1、463kJ•mol﹣1和495kJ•mol﹣1.下列热化学方程式正确的是()
A. H2O(g)═H2(g)+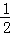 O2(g)△H=﹣485kJ•mol﹣1
O2(g)△H=﹣485kJ•mol﹣1
B. H2O(g)═H2(g)+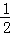 O2(g)△H=+485kJ•mol﹣1
O2(g)△H=+485kJ•mol﹣1
C. 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
分别由氕(1H)、氘(2H)、氚(3H)组成的单质(均为双原子分子),其质量均为1g,则它们:
(1)原子个数比为 .
(2)电子个数比为 .
(3)相同条件下的密度之比为 .
(4)相同条件下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(s)+bB(g)⇌cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是()
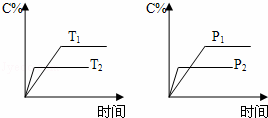
A. 达到平衡后,加入催化剂则C%增大
B. 达到平衡后,若升高温度,平衡向左移动
C. 化学方程式中b>c+d
D. 达平衡后,增加A的量,有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是()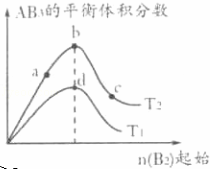
A. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为b>a>c
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是()
A. 容器内压强不随时间变化
B. v正(X)=v逆(Z)
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,一定浓度的某溶液,由水电离出的c(OH﹣﹣)=10﹣﹣4mol/L,则该溶液中的溶质可能是()
A. Na2SO4 B. CH3COOH C. NaOH D. CH3COOK
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X催化氧化的产物是(CH3)2CHCHO,有机物X是( )
A. 乙醇的同系物 B. 乙醛的同系物
C. 丙醇的同分异构体 D. 丙醛的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
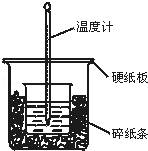
50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)烧杯间填满碎纸条的作用是 .
(2)大烧杯上如不盖硬纸板,求得的中和热的数值 (填“偏大”“偏小”“无影响”).
(3)从实验装置上看,图中尚缺少环形玻璃搅拌棒,如此求得的中和热的数值 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50mol•L﹣1盐酸跟50mL 0.55mol•L﹣1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热相等(填“相等”“不相等”),简述理由: .
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 .(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com