
| A. | 酸碱中和滴定时,滴定管以及锥形瓶在使用前需用待装液润洗 | |
| B. | 测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,再对照标准比色卡读数 | |
| C. | 萃取时,振荡过程中放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| D. | 做焰色反应时,可用光洁无锈的铁丝代替铂丝进行实验 |
分析 A.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大;
B.氯水中的次氯酸能漂白pH试纸;
C.放气是通过打开分液漏斗的活塞进行的;
D.铁无焰色反应.
解答 解:A.中和滴定中,锥形瓶不能用待测液润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高,故A错误;
B.水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH值,故B错误;
C.右手顶住瓶塞,将漏斗倒置过来.以左手控制活栓,将活栓打开先放气一次,故C错误;
D.洁净的细铁丝,放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色反应,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及中和滴定、pH试纸、萃取以及焰色反应的操作,注意操作要点,为高考常见题型,注意相关知识的学习与积累,难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
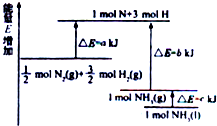 氮及其化合物与科技、生活等密切相关.
氮及其化合物与科技、生活等密切相关.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间消耗0.1 mol•L-1 A,同时消耗0.2 mol•L-1 B | |
| C. | 容器内压强不随时间变化 | |
| D. | 容器内平均相对分子质量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P1=P2 | B. | 2P1>P2 | C. | 2P1<P2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚氯乙烯都能发生加成反应 | |
| B. | 苯、乙醇和乙酸都可以发生取代反应 | |
| C. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| D. | 纤维素和蛋白质水解产物均是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com