
【题目】下列叙述正确的是( )
A. 用金属活动性顺序可解释反应:Na(l)+KCl(l)=NaCl(l)+K(g)
B. 水的电离是吸热过程,升高温度,水的离子积增大、pH减小
C. 对于平衡2HI(g)I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D. 由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
实验原理:2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
实验装置:
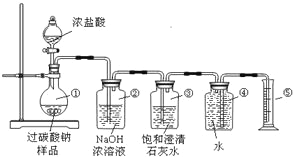
交流与讨论:
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是_________________。
(2)装置③的作用是:__________________。
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于_______________g。
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是_________________;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
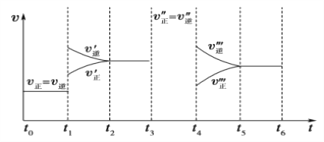
(1)下列时刻所改变的外界条件是:t1________;t4________;
(2)物质A的体积分数最大的时间段是_____;(时间段用t0~t1形式表示,下同)(3)反应速率最大的时间段是________。
(4)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 过滤B. 蒸馏C. 分液D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
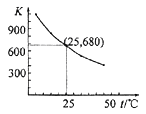
A.反应I2(aq)+I-(aq) ![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 1L 0.1 molL-1的氨水中有0.1![]() 个NH4+
个NH4+
B. 标准况下,22.4L盐酸含有![]() 个HCl分子
个HCl分子
C. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5 ![]()
D. 标准状况下,6.72 LN02与水充分反应转移的电子数目为0.2 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com