
| A、2H2(g)+O2(g)═2H2O(l)△H<0 |
| B、HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0 |
| C、2Al(s)+3Cl2(g)═2AlCl3(s)△H<0 |
| D、Zn(s)+2HCl(aq)═ZnCl2+H2(g)△H<0 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 3×10-6 | 7×10-6 | 3×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| c(NO2) |
| c(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 铁是人类应用较早,当前应用量最大的金属元素.
铁是人类应用较早,当前应用量最大的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中有晶体析出,Na+数目不变 |
| B、溶液中有气体逸出,Na+数目增加 |
| C、溶质的质量分数增大 |
| D、溶液中Na+数目减少,溶质质量分数未变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | 实验结论 | 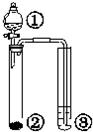 | |
| A | 稀醋酸 | CaCO3 | 澄清石灰水 | 酸性:醋酸>碳酸 | |
| B | 硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
| C | 浓盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它耐高温抗氧化 |
| B、它比钢铁轻、硬,但质地较脆 |
| C、它没有固定熔点 |
| D、它是一种新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com