
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②④⑤ | D. | ②④⑤ |
分析 硫化氢具有还原性,其水溶液具有酸性,所以硫化氢能和强氧化性物质、碱性氧化物、碱、硫化钠等物质反应;溴具有强氧化性,溴的水溶液呈酸性,所以溴能与还原性物质、碱性物质等反应,据此分析解答.
解答 解:①硫化钠溶液与硫化氢反应生成硫氢化钠,能被溴氧化生成S单质,故正确;
②二氧化硫和硫化氢发生氧化还原反应生成S,和溴水发生氧化还原反应生成硫酸和氢溴酸,故正确;
③硫酸铜溶液和硫化氢反应生成CuS沉淀,和溴不反应,故错误;
④硝酸银溶液和硫化氢反应生成硫化银沉淀,和溴水反应生成溴化银沉淀,故正确;
⑤亚硫酸钠溶液和硫化氢发生氧化还原反应,和溴发生氧化还原反应生成硫酸钠,故正确;
故选C.
点评 本题以氧化还原反应为载体考查元素化合物知识,为高频考点,明确物质性质是解本题关键,注意:硫化氢和硫化钠能反应生成酸式盐,硫化氢和硫酸铜反应生成强酸,是中学阶段学习的一个重要弱酸制取强酸的反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④② | C. | ④①②③ | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.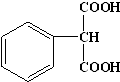 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com