
现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)________(填“大于”、“小于”或“等于”)pH(乙)。若将甲、乙两溶液等体积混合,溶液的pH=__________。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________(填“大于”、“小于”或“等于”)V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)________(填“大于”、“小于”或“等于”)c(CH3COO-)。
答案 (1)向右 向右 减小
(2)小于 2 (3)大于 (4)小于
解析 (1)根据勒夏特列原理可知,加水稀释后电离平衡正向移动;若加入冰醋酸,相当于增加了反应物浓度,因此电离平衡也正向移动;加入醋酸钠固体后,溶液中醋酸根离子浓度增大,抑制了醋酸的电离,故c(H+)/c(CH3COOH)的值减小。(2)由于在稀释过程中醋酸继续电离,故稀释相同的倍数后pH(甲)小于pH(乙)。HCl和CH3COOH溶液的pH都是2,溶液中的H+浓度都是0.01 mol·L-1,设CH3COOH的原浓度为c mol·L-1,混合后平衡没有移动,则有:
CH3COOHH++CH3COO-
原平衡浓度(mol·L-1) c-0.01 0.01 0.01
混合后浓度(mol·L-1) (c-0.01)/2 0.01 0.01/2
由于温度不变醋酸的电离常数不变,结合数据可知醋酸的电离平衡确实未发生移动,因此混合后溶液的pH仍等于2。(3)中取体积相等的两溶液,醋酸的物质的量较多,经NaOH稀溶液中和至相同pH时,消耗NaOH溶液的体积V(甲)大于V(乙)。(4)两者反应后醋酸过量,溶液显酸性,根据电荷守恒可得c(Na+)小于c(CH3COO-)。


科目:高中化学 来源: 题型:
已知反应4CO+2NO2N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1
B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1
D.v(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11,它的Ka1、Ka2差别很大的原因(从电离平衡的角度解释):_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都呈酸性
C.①②中分别加入少量CH3COONa固体,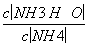 的值都变小
的值都变小
D.③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.对二甲苯的核磁共振氢谱显示有3种化学环境的氢
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种
D.某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
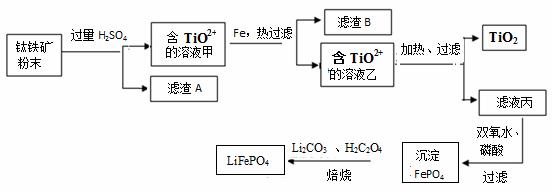
已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。

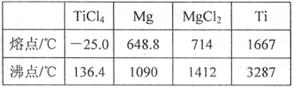 (6)TiO2制取单质Ti,涉及到的步骤如下:
(6)TiO2制取单质Ti,涉及到的步骤如下:
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是 , 由TiCl4→Ti需要在Ar气中进行的理由是 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
龙葵醛(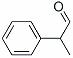 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
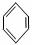
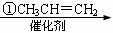
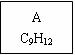
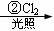
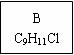

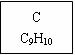
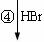
龙葵醛
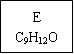
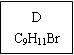
(1)龙葵醛的分子式为 ,其中含氧官能团的名称是 ;
A物质得到的1H-NMR谱中有 个吸收峰,B的结构简式可能为 。
(2)反应③的反应类型为 ,反应⑤的反应条件为 。
(3)反应⑥的化学方程式为 。
(4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com