
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为 ( )
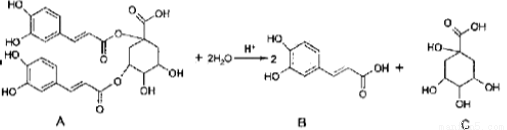
下列说法不正确的是( )
A.1mol A和足量NaOH溶液反应,最多消耗11molNaOH
B.A在一定条件下能发生取代反应、加成反应和消去反应
C.B能和浓溴水发生反应,1mol B最多消耗4 molBr2
D.C分子中含有手性碳原子
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.KOH和CaCl2既含有离子键,又含有共价键
B.PH3各原子均满足8电子稳定结构
C. 硫离子的结构示意图: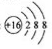
D.NH4Cl的电子式: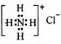
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:实验题
在有机反应中加氧去氢的反应叫氧化反应,去氧加氢的反应叫还原反应,如乙烯与氢气的加成反应也叫还原反应。1-苯乙醇因具有玫瑰香气味而广泛用于各种食用香精中,实验室用苯乙酮制备1-苯乙醇的反应、装置示意图和有关数据如下:
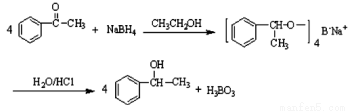
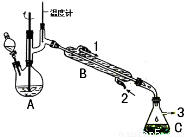
试剂[ | 熔点/℃[ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | 36 | 400 | 1.076 | 溶 | 溶 | 不溶 |
乙醇 | -117.3 | 78.4 | 0.789 | 溶 | - | 溶 |
乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |
实验步骤:
在A中加入15mL 95%的乙醇和1.0g硼氢化钠,搅拌下再滴入8mL苯乙酮,然后在搅拌的条件下,滴加足量的3mol·L-1的盐酸;使A中反应液的温度保持在75-80℃,使其中大部分乙醇蒸发,出现分层,再加入10mL乙醚。将混合反应液倒入分液漏斗中分液,水层再用10mL乙醚萃取,合并两次有机相,再进行简单蒸馏除去乙醚。最后经提纯收集到1-苯乙醇4.5g。
回答下列问题:
(1) 苯乙酮制备1-苯乙醇的反应类型是 ;
(2)仪器B的名称为______________;
(3)反应完成后,加入10mL乙醚,充分振荡后,上层为__________(填“水层”或“有机层”)
(4)反应中加入乙醇的目的是________________________________;
(5)两次合并的有机相进行蒸馏除去乙醚,采用的最佳加热方式是_________(填字母),若回收乙醚,则收集馏分的温度范围是____________________;
a.酒精为加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热
(6)本实验的产率为_____________(保留两位有效数字)。
(7) 1-苯乙醇除用作香料外也用于有机合成,如1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,写出此反应化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g)  2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
2NH3(g) ΔH<0,仅升高温度,达平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g) =TiCl4(g)+O2(g)”一定条件下可自发进行,则该反应ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:填空题
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36。请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列: (用相应的元素符号表示)。A、D两种元素中,电负性A D (填“>”或“<”)
(2)A3分子的空间构型为 ,与其互为等电子体的分子为 ;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: ,
C7H15OH 中采用sp3杂化的原子共有 个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有 (填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E (NH3)4】2+具有对称的空间构型.且当【E (NH3)4】2+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则【E (NH3)4】2+的空间构型为 (填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
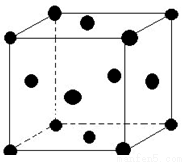
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为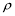 g/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式 。(用M、r、
g/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式 。(用M、r、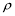 表示)
表示)
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
下列叙述错误的是 ( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=﹣114.6kJ·mol﹣1 则中和热为57.3kJ·mol﹣1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键.
A.②④⑥ B.①⑤⑥ C.①⑤⑦ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:实验题
氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
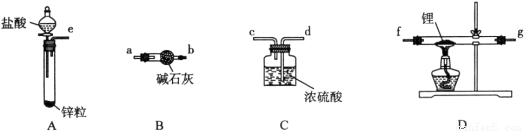
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是____________________(不必写出具体的操作方法);其中装置B的作用是________________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是______________________________________________________________________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:
LiH + H2O = LiOH + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式_________________ ___________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体0.021mol,则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。
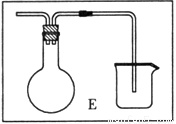
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
已知在2L密闭容器内,发生:2NO(g)+O2(g) 2 NO2(g),不能说明该反应已达到平衡状态的是( )
2 NO2(g),不能说明该反应已达到平衡状态的是( )
A.容器内颜色保持不变 B.v逆(NO)=2v正(O2)
C.单位时间内生成a mol的O2,同时生成2a molNO2 D.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、Fe2+、NO3-、Cl-
B.Ba2+、Na+、I-、NO3-
C.Na+、K+、SO42-、SO32-
D.K+、Mg2+、HCO3-、PO43-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com