
在一定温度下,将气体X和气体Y各0.16 mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)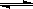 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数比原平衡大
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
下列离子方程式改写成化学方程式正确的是 ( )
A.Cu2++2OH-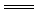 Cu(OH)2↓
Cu(OH)2↓
CuCO3+2NaOH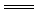 Cu(OH)2↓+Na2CO3
Cu(OH)2↓+Na2CO3
B.CO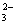 十2H+
十2H+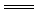 CO2↑十H2O
CO2↑十H2O
BaCO3+2HCl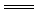 BaCl2+C02↑十H20
BaCl2+C02↑十H20
C.Ca2++CO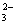
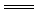 CaCO3↓
CaCO3↓
Ca(NO3)2+Na2CO3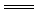 CaCO3↓+2NaNO3
CaCO3↓+2NaNO3
D.H++OH-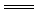 H20
H20
Ba(OH)2+H2SO4=BaSO4十2H20
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是 ( )
A.酸 B.漂白剂 C.还原剂 D.氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)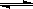 CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
CO(g)+H2(g)在一可变容积的密闭容器内进行,达到平衡后,保持其他条件不变,下列条件的改变一定能使平衡移动的是
A.增加C的质量 B.保持体积不变,充入氦气使体系压强增大
C.加入催化剂 D.保持压强不变,充入氦气使容器体积增大
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B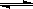 C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到
C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到
达平衡时,下列叙述不正确的是
A.若保持恒容,充入C气体后混合气体颜色加深,则说明B是有颜色的气体
B.若升高温度,发现C的物质的量减少,则说明正反应为放热反应
C.若压缩容器,平衡不移动,则说明B和D一定都是气体
D.保持恒容,到达平衡后继续充入A会使B的转化率增大,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、 美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式为 ▲ 。
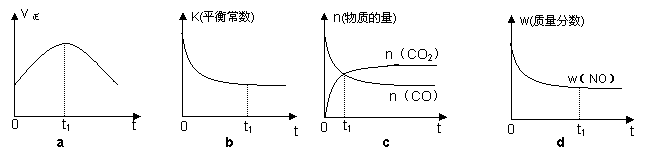
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 ▲ (填代号)。

(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
| 时间/min | CO2(mol·L-1) | H2(mol·L-1) | CO(mol·L-1) | H2O(mol·L-1) |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率为 ▲ ;
②第5—6min,平衡移动的可能原因是 ▲ ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1
2NO2(g)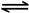 N2O4(g) △H=-56.9 kJ·mol-1
N2O4(g) △H=-56.9 kJ·mol-1
H2O(g) = H2O(l) △H = -44.0 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
▲ 。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是 ▲ mol
(6)在一定条件下,也可以用H2处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量11催化反应,其原子利用率达100%,合成的物质可能是 ▲ 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L H2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
质量分数为n的硫酸溶液,其物质的量浓度a mol/L为,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为b mol/L,则与的关系正确的是
A.b=2a B.a=2b C.b﹥2a D.b﹤2a
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH 溶液中,由水电离的OH-离子数目为0.1NA
溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3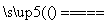 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com