
| A、卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定 |
| B、以极性键结合的分子,不一定是极性分子 |
| C、判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构 |
| D、非极性分子中,各原子间都应以非极性键结合 |


科目:高中化学 来源: 题型:
| A、两个非金属原子间可能形成离子键 |
| B、非金属原子间不可能形成离子化合物 |
| C、离子化合物中可能有共价键 |
| D、共价化合物中可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
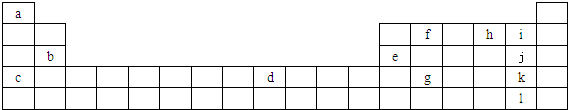
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )| A、离0点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B、C最高价氧化物的水化物不能相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下11.2L CCl4和11.2L CO2分子数相同 |
| B、CH4的摩尔质量为16g |
| C、3.01×1023个SO2分子的质量为32g |
| D、标准状况下,1mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com