
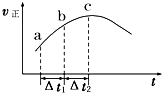
 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )| A、反应在 c 点达到平衡状态 |
| B、反应物浓度:a 点小于 b 点 |
| C、反应物的总能量低于生成物的总能量 |
| D、△t1=△t2 时,SO2 的转化率:a~b 段小于 b~c 段 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
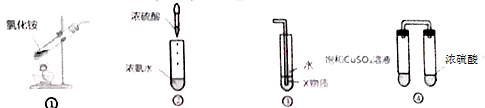
| A、实验室用装置①制取氨气 |
| B、装置②的原理可以制取氨气 |
| C、装置③中X若为四氯化碳,不可用于吸收氨气,并防止倒吸 |
| D、装置④放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、SO42-、HCO3- |
| B、CO32-、K+、Ca2+ |
| C、Fe3+、Cl-、OH- |
| D、Ag+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
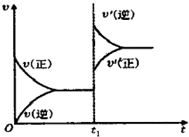 往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )| A、t1时,减小体积或升高体系温度 |
| B、平衡不移动,混合气体的密度增大 |
| C、H2的转化率增大,HI的平衡浓度减小 |
| D、容器内气体颜色变深,平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取NaCl固体23.4g |
| B、应选用500mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2cm时改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
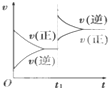 对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )
对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )| A、A、B、C是气体,D不是气体 |
| B、A、B是气体,C、D有一种是气体 |
| C、C、D是气体,A、B有一种是气体 |
| D、A、B、C、D都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
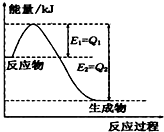 (1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:
(1)一定条件下,N2和H2反应生成lmolNH3过程中能量变化如右图所示,则1mol N2完全反应时的焓变为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com