
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )

A.甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象
B.乙是等PH值的MCl2和NCl2溶液稀释时PH值变化图,由此可推测M的金属性较强
C.由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H2O(l)+O2(g)△H=﹣2(Ea2′﹣Ea2) kJ•mol﹣1
D.丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2015-2016学年海南华侨中学三亚学校高二下期末理科化学试卷(解析版) 题型:选择题
根据有机物的结构推测,它可能发生的反应有﹙﹚
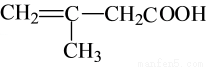
①氧化反应
②加成反应
③酯化反应
④中和反应.
A.只有②③④ B.只有①②③ C.①②③④ D.只有②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年全国高三模拟试卷总结化学试卷 题型:选择题
(2015•莲湖区校级二模)下列相关离子方程式书写正确的是( )
A.NaClO溶液与FeCl2溶液混合:6Fe2++3ClO﹣+3H2O═2Fe(OH)3↓+3Cl﹣+4Fe3+
B.用食醋检验牙膏中的碳酸钙:CaCO3+2H+═Ca2++CO2↑+H2O
C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O
D.电解MgCl2水溶液的离子方程式:2Cl﹣+2H2O H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源:2016届福建省南平市浦城县高考模拟化学试卷(解析版) 题型:选择题
25℃时,向100mL 1mol•L﹣1H2SO3溶液中逐渐滴入1mol•L﹣1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=﹣lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
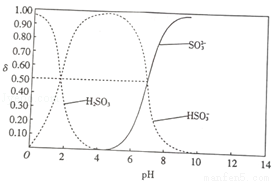
A.pH=1.85时,c(H2SO3)=c(HSO3﹣)
B.pH=6时,c(Na+)>c(HSO3﹣)>c(SO32﹣)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO3﹣)+2c(SO3﹣)+c(OH﹣)
D.加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市青浦区高考二模化学试卷(解析版) 题型:填空题
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
(1)基态氮原子的价电子排布图为 .
(2)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 .
(3)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),工业制备X的化学方程式为 .
(4)X晶体中包含的化学键类型为 (填字母标号).
A.离子键 B.共价键 C.配位键 D.金属键
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,其原因是 .
(6)若X的密度为ρg/cm3,则晶体中最近的两个Al原子的距离为 cm (阿伏加德罗常数用 NA表示,不必化简).
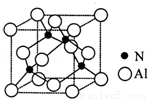
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市青浦区高考二模化学试卷(解析版) 题型:选择题
下列有关核外电子的运动状态的说法中错误的是( )
A. 电子亚层(能级)是描述电子运动的电子云状态
B. 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来
C. 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数
D. 电子云伸展方向与能量大小是无关的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷(解析版) 题型:选择题
选项 | 实验事实 | 理论解释 |
A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
B | 白磷为正四面体分子 | 白磷分子中P﹣P﹣P的键角是109.5° |
C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
D | 键的极性:H﹣O>N﹣H | 非金属性差异越大,键的极性越小 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省南通市如皋市高一下期中化学试卷(解析版) 题型:填空题
有关物质的转化关系如图所示(部分物质和条件已略去).A是常见金属单质;B、C、D、H常温下是气态,其中D呈红棕色,F、G是常见强酸,E是最常见的无色液体,I的组成元素与E相同,J的溶液呈蓝色.
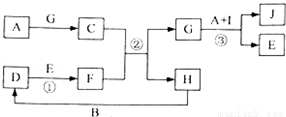
(1)D的化学式为 .I的电子式为 .
(2)若有1molD参加反应①,反应中转移的电子数为 .
(3)反应②的离子方程式为 .
(4)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目 .
(5)反应③开始后,其化学反应速率突然增大,原因是 .
a、该反应为吸热反应
b、物质G的浓度增大
c、反应产物作催化剂
(6)从J的水溶液中获得含结晶水晶体的操作是蒸发浓缩、 、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下6月月考化学试卷(解析版) 题型:填空题
有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
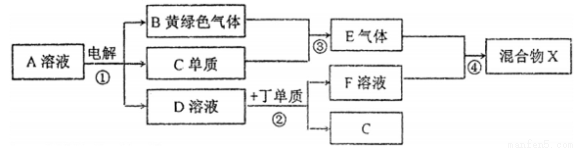
请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为_____________;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是____________________。
(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为___________。
(3)上图转化关系中不属于氧化还原反应的有(填编号)____________。
(4)接通右图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为______。

(5)当反应①电解一段时间后测得D溶液pH=12(常温下,假设气体完全逸出,取出交换膜后溶液充分混匀,忽略溶液体积变化),此时共转移电子数目约为________;反应②的离子方程式为_______________。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(陈水外)有_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com