
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
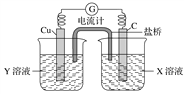
(1)写出电极反应式:正极___________________;负极_________________。
(2)图中X溶液是____________,Y溶液是____________。
(3)原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(4)X溶液中石墨电极上发生____________(填“氧化”或“还原”)反应
【答案】 2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2 阳 还原
【解析】试题分析:(1)反应Cu+2FeCl3=CuCl2+2FeCl2中,Cu失电子发生氧化反应,Fe3+得电子发生还原反应;原电池中正极发生还原反应、负极发生氧化反应。(2)根据电池总反应,正极是氯化铁发生还原反应;为防止铜发生自放电,铜与Y溶液不能反应;
(3)原电池中阳离子移向正极;(4)原电池中正极发生还原反应、负极发生氧化反应。
解析:(1)反应Cu+2FeCl3=CuCl2+2FeCl2中,Cu失电子发生氧化反应,Fe3+得电子发生还原反应;原电池中正极发生还原反应,所以C是正极,正极反应式是2Fe3++2e-=2Fe2+;负极发生氧化反应,Cu是负极,负极反应式是Cu-2e-=Cu2+;。(2)石墨是正极,正极反应是2Fe3++2e-=2Fe2+,所以图中X溶液是FeCl3,Cu是负极,Y溶液是CuCl2;(3)原电池工作时阳离子移向正极,石墨是正极,所以盐桥中的阳离子向X溶液方向移动;(4)石墨是正极,所以X溶液在石墨电极发生氧化反应。


科目:高中化学 来源: 题型:
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表示确的是
A. 原子结构示意图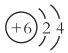 只能表示12C原子
只能表示12C原子
B. 黄钾铁矾[KFe3(SO4)2(OH)6]中,Fe的化合价为+2
C. ![]() 系统命名法为3-丁烯
系统命名法为3-丁烯
D. 甲基的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠的反应实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④
B. ①②③
C. ①②④
D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1mol SO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示。已知电池放电时的反应为4Li+FeS2==Fe+2Li2S。下列说法正确的是( )
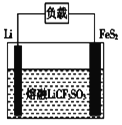
A. Li为电池的正极
B. 电池工作时,Li+向负极移动
C. 正极的电极反应式为FeS2+4e-=Fe+2S2-
D. 将熔融的LiCF3SO3改为LiCl的水溶液,电池性能更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定实验类似,现用0.1000mol/L的酸性高锰酸钾溶液滴定未
知浓度的无色亚硫酸氢钠溶液,回答下列问题:
(1)滴定前润洗滴定管的操作方法__________。
(2)某同学测得的实验数据如下表
1 | 2 | 3 | 4 | |
亚硫酸氢钠溶液体积mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初体积mL | 0.00 | 1.02 | 1.00 | 0.80 |
滴定管末体积mL | 40.02 | 41.00 | 41.00 | 42.90 |
求待测液亚硫酸氢钠的物质的量浓度________。
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,则计算值比实际值___(填“偏高”或“偏低”或“不变”) 。
(4)常温下0.1000mol/L亚硫酸溶液中H2SO3 HSO3- SO32-三者所占物质的量分数(a)随pH变化的关系如图所示,已知lg2=0.3,则原亚硫酸氢钠溶液的pH=_______:
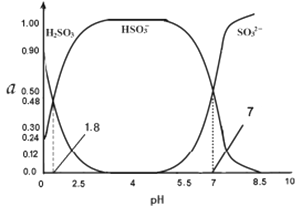
(5)取上述亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,(假定加固体后溶液的体积不变),则该溶液能溶解硫酸钡的物质的量n=______(已知该温度时KSp(BaSO4)=1.0×10-10 KSp(BaSO3)=1.0×10-8 )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com