
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/molI2=1451kJ/molI3=7733kJ/molI4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
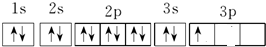 ,
, ;
;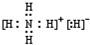 ,
,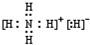 ;
; ,
, .
.

科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:H2O>HF>H2S |
| B.最高正化合价:F>N>C |
| C.非金属性:Cl>S>Si |
| D.酸性:H2CO3>H3PO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.每一周期元素都是从碱金属开始,以稀有气体结束 |
| B.f区都是副族元素,s区和p区的都是主族元素 |
| C.已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol |
| D.Ge的电负性为1.8,则其是典型的非金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,硫为浅黄色固体,而氯为黄绿色气体 |
| B.跟金属反应和氢气反应时,硫被还原为-2价,氯被还原为-1价 |
| C.硫不溶于水而氯气能溶于水 |
| D.跟同一种金属(如Fe或Cu)反应时,金属被硫氧化成低价态,被氯氧化成高价态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第一电离能:B<C<N<O | B.最高正价:F>O>N>C |
| C.电负性:O>C>Si>Na | D.半径:Na+>Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径大小:Na>S>O |
| B.金属性强弱:K>Na>Ca |
| C.酸性强弱:HIO4>HBrO4>HClO4 |
| D.碱性强弱:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。下列说法正确的是
。下列说法正确的是| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线形共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由Y、Z、M三种元素形成的化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
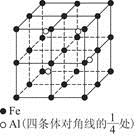
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com