
| A. | FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| C. | 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.稀硝酸具有强氧化性,能够氧化亚铁离子和硫离子;
C.氢氧化钙足量,漏掉了镁离子与氢氧根离子生成氢氧化镁的反应;
D.铝离子完全沉淀时,明矾与氢氧化钡的物质的量之比为2:3,离子方程式按照氢氧化钡的化学式组成书写.
解答 解:A.FeCl2溶液中通入氯气,反应生成氯化铁,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.稀硝酸能够氧化FeS,正确的离子方程式为:NO3-+FeS+4H+=Fe3++S+NO↑+2H2O,故B错误;
C.碳酸氢镁与足量氢氧化钙反应生成碳酸钙、氢氧化镁沉淀和水,正确的离子方程式为:2Ca2++4OH-+Mg2++2HCO3-═Mg(OH)2↓+2CaCO3↓+2H2O,故C错误;
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全,明矾与氢氧化钡的物质的量之比为2:3,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:选择题
| A. | 若将该反应设计成原电池,反应时化学能转化为电能 | |
| B. | △H的值与反应方程式的化学计量数有关 | |
| C. | 若将该反应设计成原电池,铁棒为负极 | |
| D. | 若将其设计为原电池,当有28gFe溶解时,正极放出气体的体积11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
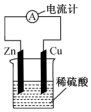
| A. | 锌片为正极 | |
| B. | 该电池工作时电能转化为化学能 | |
| C. | 该电池的总反应为Zn+2H+═Zn2++H2↑ | |
| D. | 电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠是一种淡黄色固体 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 过氧化钠与水反应后的溶液滴加几滴酚酞溶液,溶液会变为红色 | |
| D. | 1mol过氧化钠与水反应可生成1mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol石炭酸根含有的电子数目为49NA | |
| B. | 标况下1L已烷完全燃烧后恢复至原状态,生成气态物质分子数为$\frac{6{N}_{A}}{22.4}$ | |
| C. | 1 mol甲基含有9NA个电子 | |
| D. | 0.1 mol甘油与足量的钠反应,可生成氢气3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.
I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、AgNO3、Na2CO3 | B. | AgNO3、HCl、BaCl2、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | AgNO3、HCl、Na2CO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泡沫灭火器利用硫酸铝和小苏打溶液反应的产物来灭火 | |
| B. | 为使水果尽快成熟,可用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯 | |
| C. | 煤的干馏、燃煤烟气的脱硫、煤的液化和气化等过程都是化学变化 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)阴、阳离子的个数之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com