
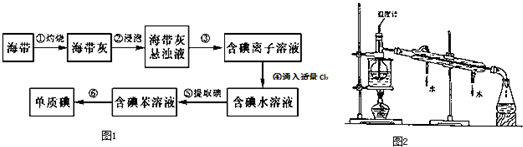
分析 从海带中提取碘:海带灼烧后得到海带灰浸泡后得到海带灰的浊液,将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,过滤得到含碘离子的溶液加入二氧化锰和稀硫酸氧化碘离子为碘单质,离子方程式为:2I-+MnO2+4H+=Mn2++I2+2H2O,得到含碘水溶液,加入有机溶剂苯,萃取分液得到含碘的苯溶液,通过蒸馏得到碘单质,
(1)步骤③得到含碘离子的溶液;
(2)MnO2具有较强的氧化性,在酸性条件下可氧化碘离子;Cl2或双氧水(H2O2)可氧化碘离子;
(3)根据蒸馏实验的注意事项回答;水浴加热试管内试剂受热比较均匀;步骤⑥是从含碘苯溶液中分离出单质碘和回收苯;所以碘在蒸馏烧瓶中聚集;
(4)MnO2具有较强的氧化性,在酸性条件下可氧化碘离子;若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,反应生成碘单质;
(5)根据碘单质遇到淀粉变蓝的特性来检验;
(6)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液.
解答 解:(1)步骤③得到含碘离子的溶液,说明海带中是化合态的碘元素,主要存在形式是I-,故答案为:I-;
(2)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是,坩埚、酒精灯、坩埚钳;
故答案为:CD;
(3)根据蒸馏的注意事项可知,图中出现以下错误:
①温度计水银球的位置错误,应与蒸馏瓶支管下沿平齐;
②烧杯下没垫石棉网,否则加热时会受热不均而炸裂;
③冷冷凝管中凝水的流向错误,冷水应从下方进,上方出;又用酒精灯直接加热温度变化快,而水浴加热试管内试剂受热比较均匀,
故答案为:①温度计水银球的位置错误,应与蒸馏瓶支管下沿平齐;②烧杯下没垫石棉网,否则加热时会受热不均而炸裂;③冷冷凝管中凝水的流向错误,冷水应从下方进,上方出;试剂受热均匀;
反应温度低于100℃,受热均匀,容易控制反应温度;步骤⑥是从含碘苯溶液中分离出单质碘和回收苯;所以碘在蒸馏烧瓶中聚集;
故答案为:温度计水银球位置没有放在蒸馏烧瓶的支管口;冷凝管中的水流方向错误;加热时在烧杯上没有垫石棉网;受热均匀;容易控制反应温度;反应温度低于100℃;蒸馏烧瓶;
(4)碘离子在酸性条件下可被MnO2氧化;Cl2或双氧水(H2O2)可氧化碘离子,反应的离子方程式为:2I-+MnO2+4H+=Mn2++I2+2H2O,若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I-,反应的离子方程式为:5I-+6H++IO3-=3I2+3 H2O,
故答案为:2I-+MnO2+4H+=Mn2++I2+2H2O; 5I-+6H++IO3-=3I2+3 H2O;
(5)碘遇淀粉变蓝色,故答案为:淀粉;
(6)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则步骤为C→B→D→A→G→H→E→F,故答案为:C;B;D;H.
点评 本题考查了分液的步骤和萃取剂的选择,选择萃取剂紧扣萃取剂的选择标准判断即可,要注意分馏汽油和热裂汽油在性质上的不同,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 2g | B. | 4g | C. | 8g | D. | 18g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
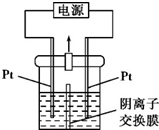 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
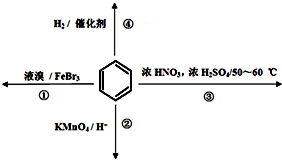
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com