
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
分析 恒容容器甲与恒压容器乙开始时的体积相同,均充有1molCH4和1molCO2的混合气体,发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ/mol,反应是气体体积增大的吸热反应,恒压容器乙中 体积增大,相当于甲容器压强减小,平衡向气体体积增大的方向进行,据此分析平衡变化后的量的变化;
解答 解:恒容容器甲与恒压容器乙开始时的体积相同,均充有1molCH4和1molCO2的混合气体,发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ/mol,反应是气体体积增大的吸热反应,恒压容器乙中 体积增大,相当于甲容器压强减小,平衡向气体体积增大的方向进行,
A.恒压容器乙中 体积增大,相当于甲容器压强减小,平衡向气体体积增大的方向进行,甲、乙中CO的体积分数不相同,乙中CO体积分数大,故A错误;
B.乙达到平衡状态时的压强小于甲,所以达到平衡所需时间长,达到平衡时,甲用时间比乙短,故B正确;
C.依据分析可知恒压容器乙中 体积增大,相当于甲容器压强减小,平衡向气体体积增大的方向进行,平衡正向进行,甲中CO2的转化率比乙低,故C错误;
D.恒容容器甲中充入氦气是与化学平衡无关的物质,总压增大分压不变,平衡不变,恒压容器乙中充入同量的氦气,体积增大压强减小,平衡正向进行,故D错误;
故选B.
点评 本题考查了恒容容器甲与恒压容器乙的平衡建立过程,影响化学平衡因素的分析判断,主要是改变条件后平衡移动原理的应用判断出平衡移动的方向,题目难度中等.


科目:高中化学 来源: 题型:选择题
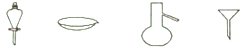
| A. | 蒸馏、蒸发、萃取、过滤 | B. | 蒸馏、过滤、萃取、蒸发 | ||
| C. | 过滤、蒸发、萃取、蒸馏 | D. | 萃取、蒸发、蒸馏、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.烟花的颜色 | B.贴春联 | C.鞭炮的燃放 | D.包饺子 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.
某无色溶液中阴离子为Cl-,阳离子可能含有下列离子中的一种或几种:H+、K+、Al3+、NH4+、Fe3+,向该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH 溶液的体积(V)的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
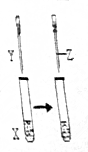 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( ) | X | Y | Z | 实验现象 | |
| A | 苯酚 | NaOH | 盐酸 | 浑浊液变澄清,后又变浑浊 |
| B | FeCl3 | KSCN | KCl固体 | 溶液变为红色,后颜色加浑 |
| C | KI | 足量氯水 | 乙醇 | 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色 |
| D | Na2SO3 | Ba(NO3)2 | 盐酸 | 生成白色沉淀,后沉淀溶解,有大量气体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com