
下列(1)至(4)因果关系题,每题均由论断与理由两部分组成,请用相关要求的A、B、C、D序号作答.
|
|
A |
B |
C |
D |
|
论断 |
正确 |
正确 |
错误 |
错误 |
|
理由 |
正确 |
错误 |
正确 |
错误 |
(1)论断:具有n个电子层的原子,核外电子数必等于![]() 个
个
理由:原子核外各电子层最多可容纳![]() 个电子
个电子
答案______________________________.
(2)论断:氯元素的相对原子质量为35.5
理由:自然界中![]() 和
和![]() 的质量分数分别25%和75%
的质量分数分别25%和75%
答案_____________________________.
(3)论断:同种元素的原子其质量数不一定相同
理由:元素的种类由原子核内质子数决定,不受中子数影响
答案_____________________________.
(4)论断:同种元素的原子一定相同
理由:不同种原子一定属于不同元素
答案_____________________________.
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:

| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题| 鉴别对象 | 所选试剂 | 反应的离子方程式 |
| Cu2+ | NaOH溶液 NaOH溶液 |
Cu2++2OH-=Cu(OH)2↓ Cu2++2OH-=Cu(OH)2↓ |
| SO42- | 稀盐酸,BaCl2溶液 稀盐酸,BaCl2溶液 |
Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
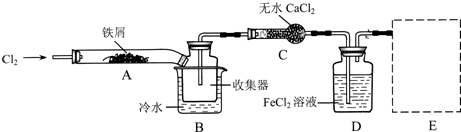
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
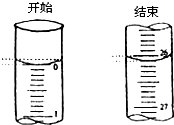 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com