
下列递变情况中不正确的是
A.HF、HCl、HBr、HI的沸点依次升高
B.硅、磷、硫、氯元素的最高正化合价依次升高
C.O2-、F-、Na+、Mg2+的离子半径依次增大
D.锂、钠、钾、铷的金属性依次增强
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:填空题
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
①A是一种有机酸,分子式为C9H10O3。
②B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
③C的相对分子质量为78,且分子中只有一种氢原子。
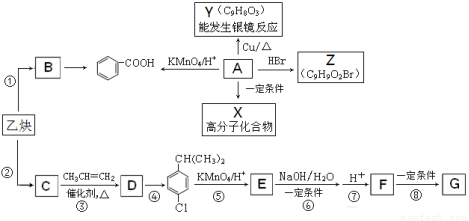
(1)写出乙炔分子的电子式 , F中的含氧官能团名称 ;
(2)上述①至⑧的反应中,属于加成反应的有 ,第④步反应所需的试剂和条件是 ;
(3)写出A的结构简式 ;
(4)下列有关的描述中,正确的是 ;
a. 1molB最多能与4molH2加成
b. B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c. B、C、D是同系物
d. A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
将通有H2S的导气管伸入充满氧气的集气瓶内点燃,描述反应过程的曲线错误的是
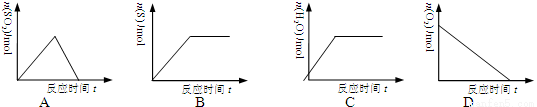
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)
如图所示,是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答:
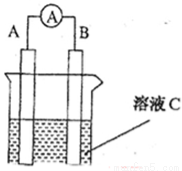
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于有机物的叙述中,不正确的是
A.烷烃的同系物的分子式可用通式CnH2n+2表示
B.互为同系物的有机物也互为同分异构体
C.两个同系物之间的相对分子质量差为14或14的整数倍
D.同分异构体间具有相似的化学性质
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
除去乙烷中乙烯的办法是
A.通过酸性高锰酸钾溶液 B.通过溴水 C.通过浓硫酸 D.通过石灰水
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为a,则B的原子序数不可能为
A.a+8-m-n B. a-16-m-n C.a+16-m-n D.a-m-n
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
元素 | A | B | C | D |
性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
请按要求回答下列问题:
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
下列说法不正确的是
A.在pH<4溶液中 ,碳钢主要发生析氢腐蚀
B.存pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com