
| A. | 1.6 mol/(L•s) | B. | 0.16 mol/(L•s) | C. | 0.32mol/(L•s) | D. | 0.8 mol/(L•s) |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
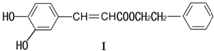
| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g•(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
 (用化学方程式表示).
(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿:Fe3O4 | B. | 铜绿:Cu2(OH)2CO3 | C. | 磁铁矿:Fe2O3 | D. | 明矾:2KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则2molH2(g)和1molO2(g)所含有的总能量比2molH2O(l)所含有的总能量少483.6kJ | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com