
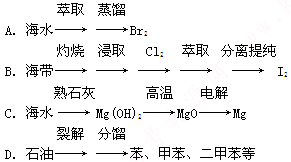
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。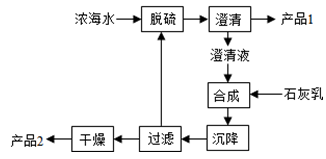

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
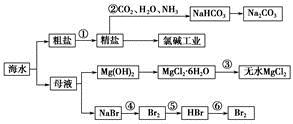
| A.步骤②中,应先通CO2,再通NH3 |
| B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水 |
| C.步骤④、⑤、⑥反应中,溴元素均被氧化 |
D.除去粗盐中的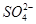 、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此法对环境不会造成任何污染 |
| B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 |
| C.若提取12 kg Mg,则电子转移1 000 mol |
| D.以上提取镁的过程涉及的离子反应共有3个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤②④ | B.②①③④⑤ |
| C.②④①③⑤ | D.③①②⑤④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com