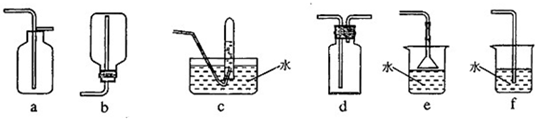
在浓CaCl
2溶液中通入NH
3和CO
2,可以制得纳米级碳酸钙.下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.

(1)实验室若用NH
4Cl和熟石灰作试剂来制取、收集干燥的NH
3,则需选用上述仪器装置中的
BDE
BDE
(填装置序号).若要制取、收集干燥的CO
2,请选择装置并按气流方向连接各仪器接口
acdh
acdh
.
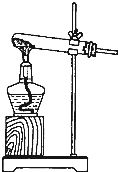
(2)若在A的分液漏斗内改加浓氨水,圆底烧瓶内加NaOH固体,也能制取氨气.请解释装置A中能产生氨气的原因
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出
氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出
.
(3)向浓CaCl
2溶液中通入NH
3和CO
2气制纳米级碳酸钙时,应先通入的气体是
NH3
NH3
,若实验过程中有氨气逸出,应选用下列
b
b
装置回收(填代号).

写出制纳米级碳酸钙的化学方程式
CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl
.
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是
取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是
.