
| A、金属钠着火时,可用泡沫灭火器灭火 |
| B、蒸发结晶时应将溶液蒸干 |
| C、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| D、在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Cl2>I2>Fe3+>SO2 |
| B、Cl2>Fe3++>I2>SO2 |
| C、Fe3+>Cl2>I2>SO2 |
| D、Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g氧气和臭氧的混合物中含有NA个氧原子,该混合物的体积一定小于11.2 L |
| B、1 L 0.2 mol/L的CH3COOH溶液中,H+数目为0.2NA |
| C、5.6g铁与足量氯气或硫蒸气反应转移的电子数为0.3NA |
| D、在常温常压下,等质量的H2和O2的体积之比是16:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、向NaAlO2溶液中通入少量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、过量的二氧化碳与氢氧化钠反应:CO2+OH-=HCO3- |
| D、少量的氢氧化钠和碳酸氢钙反应:Ca2++2HCO3-+OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
26 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物 |
| B、油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| C、处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 |
| D、推广可利用太阳能、风能的城市照明系统,发展低碳经济和循环经济,有利于改善环境质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
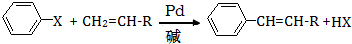 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)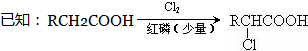
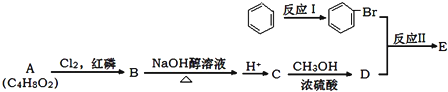
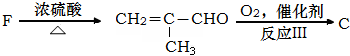
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com