
| ||
| ||
| ||
| ||
| 16.4g |
| 40g/mol |


科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
| A、相同pH的两种酸溶液中,CH3COOH溶液中水电离的试c(H+)浓度较大 |
| B、物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液pH较大 |
| C、等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D、HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka?K=KW |
查看答案和解析>>
科目:高中化学 来源: 题型:
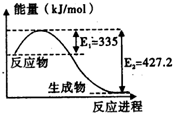 (1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe |
| B、Li-Al合金在电池中作为负极材料 |
| C、负极的电极反应式为Al-3e-=Al3+ |
| D、充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
 完成下列各题:
完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L1.0mol?L-1CH3COOH溶液中,CH3COOH分子数为NA |
| B、1 molNa2O2与足量H2O反应转移的电子数NA |
| C、常温常压下,22.4L的D2、H2组成的气体分子数约为NA |
| D、4.6g NO2和N2O4的混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、石灰乳与Na2CO3溶液混合:Ca 2++C
| ||||
B、向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O
| ||||
C、向CH2BrCOOH中加足量的氢氧化钠溶液并加热:CH 2BrCOOH+2OH-
| ||||
| D、FeO与稀硝酸反应:FeO+6H++NO3-=Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,分子数为NA的C0、C2H4.混合气体体积约为22.4L,质量为28g |
| B、25℃时,pH=2的1.OL H2SO4溶液中含有的H+数目为0.2NA |
| C、4.6g Na在空气中完全反应生成Na2O Na2O2混合物,转移电子数目为0.2NA |
| D、1mol金刚石和晶体桂的混合物中,含有共价键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molO2与金属单质完全反应转移电子一定为4NA |
| B、标准状况下,22.4L空气中含有NA个气体分子 |
| C、标准状况下,11.2L一氧化氮与11.2L氧气混合后的气体分子数为NA个 |
| D、通常状况下,23g二氧化氮与四氧化二氮混合气体含有的原子数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com