
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
分析 500mL0.2mol•L-1氨水中含有溶质一水合氨的物质的量为0.1mol,
A.由于一水合氨部分电离,则溶液中NH3•H2O物质的量减小;
B.氨水的溶质为一水合氨;
C.氨水中含有NH3、NH3•H2O和NH4+;
D.根据物料守恒计算NH3、NH3•H2O和NH4+的物质的量之和.
解答 解:500mL0.2mol•L-1氨水中含有溶质一水合氨的物质的量为:0.2mol/L×0.5L=0.1mol,
A.NH3•H2O在溶液中发生电离,则溶液中含有NH3•H2O的物质的量小于0.1mol,故A错误;
B.该氨水中溶质NH3•H2O的浓度为0.2mol/L,故B错误;
C.根据物料守恒可知:c(NH3)+c(NH3•H2O)+c(NH4+)=0.2mol/L,故C错误;
D.根据物料守恒可得:n(NH3)+n(NH3•H2O)+n(NH4+)=0.1mol,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握物料守恒的含义及应用,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
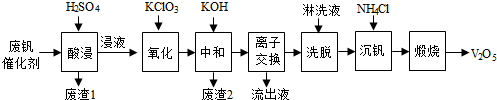
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

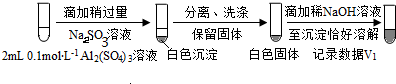
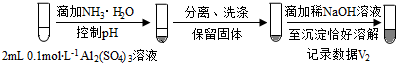 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该醇至少含有两个碳原子 | B. | 该醇分子中一定没有甲基 | ||
| C. | 该醇分子中一定含有甲基 | D. | 该醇分子中含有一个醇羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com