
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
分析 短周期的三种元素分别为X、Y和Z.Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半,则其M层电子数为5,故Y为P元素;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个,则Z元素L层有6个电子,故Z为O元素;X元素的原子最外层只有一个电子,则X处于ⅠA族,判断可能的化合价,根据化合价可判断可能的化学式.
解答 解:Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半,则M层有5个电子,故Y为P元素,为+3、+5价等;Z元素原子的L电子电子数比Y元素原子的L电子层上电子数少2个,则Z元素L层有6个电子,故Z为O元素,为-2价,X元素的原子最外层只有一个电子,则X处于ⅠA族,X+1价.
A.X2YZ3中Y的化合价为+4价,不符合,故A错误;
B.X2YZ4中Y的化合价为+&价,不符合,故B错误;
C.X3YZ4中Y的化合价为+5价,符合,故C正确;
D.X4Y2Y7中Y的化合价为+5价,符合,故D正确.
故选:AB.
点评 本题考查原子结构与元素性质,注意根据原子核外电子排布推断元素种类,并结合化合价判断可能的化合物,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
标准状况下某种O2和N2的混合气体x g含有a个分子,则y g该混合气体在相同状况下所占的体积应是( )
A. L B.
L B. L C.
L C. L D.
L D. L
L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
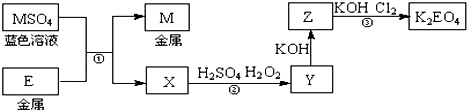
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 | |
| C. | 由于铝的导电性比铜、银都强,所以常用来制造电线、电缆 | |
| D. | NH3能氧化氮氧化物,可用于汽车尾气净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊烷有两种同分异构体 | |
| B. | 乙烷,乙醇和苯均不能使酸性高锰酸钾褪色 | |
| C. | 乙醇,乙酸和乙酸乙酯可用碳酸钠溶液加以区别 | |
| D. | 乙烯,聚氯乙烯和苯分子均含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 预期现象 | 结论 |
| 假设一成立 |
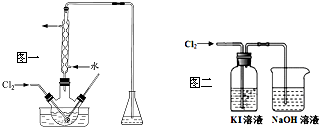
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com