
用NA表示阿伏德罗常数,下列叙述一定正确的是( )
A.标准状况下,2.24LH2O含有的质子数为 NA
B.等物质的量的氮气和氧气,都含有2NA个原子
C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于阿伏加德罗常数的说法正确的是( )
A.阿伏加德罗常数是12 g碳中所含的碳原子数
B.阿伏加德罗常数是0.012 kg 12C中所含的原子数
C.阿伏加德罗常数是6.02×1023
D.阿伏加德罗常数的符号为NA,近似为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A.B.C三种化合物,各取40g相混合,完全反应后,得18g B,49g C,还有D生成。已知D的相对分子质量为106。现将22g A和11g B反应,能生成D的物质的量为
A.1 mol B.0.5 mol C.0.275 mol D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
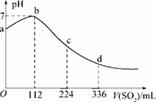
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO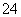 ,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
________________________________________________________________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:
________________________________、________________________________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将28克铁粉溶于500mL的某稀硝酸溶液中,二者刚好完全反应,已知还原产物只有NO,且反应后的溶液比反应前增加了16克,则原硝酸浓度是( )mol/L
A. 6.4 B. 4.8 C.3.2 D.2.4
查看答案和解析>>
科目:高中化学 来源: 题型:
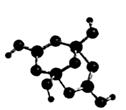 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2 +与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
(1)写出Z的基态原子外围电子排布_______________________。
(2)R的某种钠盐晶体,其阴离子Am- (含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有____________;m=____________。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为______________________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是______________________。
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似。若晶胞边长为a pm,则晶胞的密度为___________________________g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
若将P原子的电子排布式写成1s22s22p63s23px23py1,它违背了
A. 能量守恒原理 B. 泡利不相容原理 C. 能量最低原理 D. 洪特规则
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com