
甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列关于有机物的认识正确的是
A.油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都会水解
B.丁烷(C4H10)和二氯甲烷都存在同分异构体
C.只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液
D.汽油、柴油、植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g) ?H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)=2:1:1
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)=0.3 mol/L、c(CH3OCH3)=0.6 mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ?H=-a kJ/mol ②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)

A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3 ③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol ④
H2O(l)=H2O(g) △H5=+44KJ/mol ⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
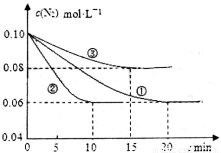
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
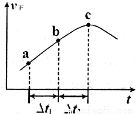
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的NaOH的物质的量相等
B.若NaHA溶液的pH<7,则H2A一定是强酸
C.将NaOH溶液加入到NH4Cl溶液至中性时,溶液中c(NH4+)=c(Cl一)
D.常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 L 0.2mol/LCH3COONa溶液中含有0.2NA个CH3COO—
B.标准状况下,11.2LCl2溶于水,转移的电子数为NA
C.常温常压下,23g NO2和N2O4的混合气体含有的原子数为1.5NA
D.100 mL 18.4mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.92NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq)  CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率
CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率 随时间变化的关系曲线(
随时间变化的关系曲线(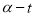 )如图所示。
)如图所示。

下列说法正确的是
A.b代表40℃时CH3COCH3的a—t曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
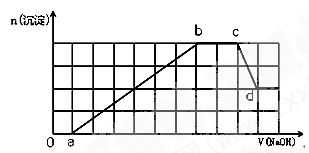
A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓
B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.d点溶液中含有的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
一氯氨(NH2 Cl)中氨基带部分负电荷,预计它跟水反应的最初生成物是
A.NH2OH和HCl B.NH3·H2O和HCl
C.NH3和HClO3 D.NH3和HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com