
(物质结构与性质)砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是____________
(3) As4O6的分子结构如图所示,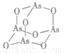 其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
(4)As与N是同主族元素,AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是____________
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3Asq 强的原因是_________________
(7)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,
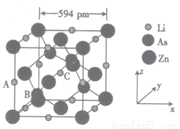
其中原子坐标参数A 处Li 为(0,0,1/2);B处As为(1/4,1/4;1/4);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs 单晶的晶胞参数,a ="594pm" , NA表示阿伏加德罗常数的数值,其密度为__________g·cm-3(列出计算式即可)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届河南省高三第一次月考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
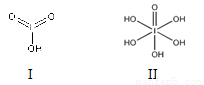
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
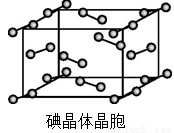
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
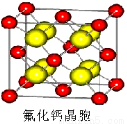
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列离子的检验方法合理的是 ( )
A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市增城区四校高三第一次联考理综化学试卷(解析版) 题型:填空题
(选修二 : 化学与技术)
MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.其主要工艺如下:
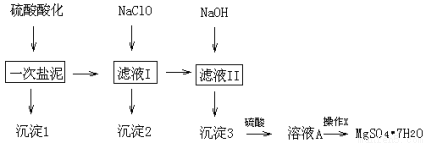
表1:生成氢氧化物沉淀的PH
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Al(OH)3 | 3.7 | 5.7 |
开始溶【解析】 | 完全溶【解析】 |
根据工艺流程和表1,请回答下列问题:
(1)用H2SO4调节溶液PH至1~2,H2SO4作用是
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是
(4)“操作X”是将溶液 、过滤洗涤,即得到MgSO4·7H2O晶体.
(5)电解溶液A能否得到单质Mg (填“能”或“不能”),阳极反应式为
(6)准确称量制得的样品5g,用200mL水溶解,加入2mol·L-1的盐酸5mL,在不断搅拌下滴加足量2mol·L-1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 .
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市增城区四校高三第一次联考理综化学试卷(解析版) 题型:选择题
关于下列图示的说法中,正确的是:
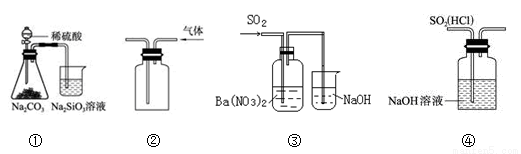
A.图①所示实验可比较硫、碳、硅的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③所示实验装置制备BaSO3沉淀
D.图④装置可以用来除去SO2中的HCl
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:实验题
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化
物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
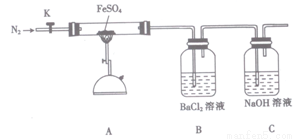
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却。
(2)已知M中铁元素的质量分数为70%,M的化学式为__________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验。
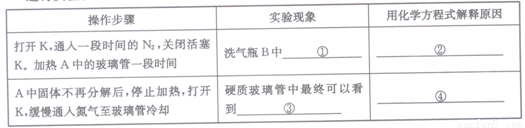
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
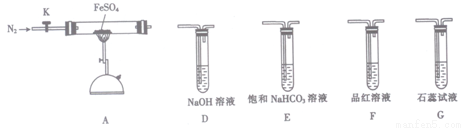
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A →________ →________。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:选择题
一种制取粗碘的工艺流程如图所示,下列有关说法不正确的是( )
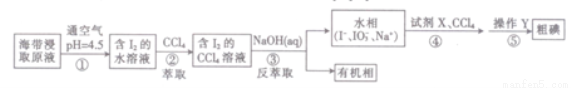
A.步骤②中的萃取过程为物理变化
B.步骤③发生的反应中I2是氧化剂,NaOH是还原剂
C.步骤④所加的试剂X可能是稀硫酸
D.步骤⑤涉及的主要操作Y为分液和蒸馏
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高新部高三上学期一轮复习第一次测试化学试卷(解析版) 题型:选择题
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
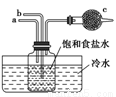
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3然后a通入CO2,c中放碱石灰
C.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
D.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三暑假开学调研化学试卷(解析版) 题型:计算题
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g。另一份加入含0.001mol KMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。(填离子符号)
(2)试通过计算确定该结晶水合物的化学式。 (写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com