
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算;
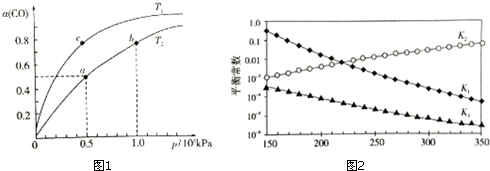
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③达到化学平衡状态的是各物质的浓度不变,正逆反应速率相等;
④结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(3)反应1、2、3其对应的平衡常数分别为K1、K2、K3,根据图1它们随温度变化的曲线结合盖斯定律进行分析解答.
解答 解:(1)反应焓变=反应物键能总和-生成物键能总和,即CO(g)+2H2(g)?CH3OH(g),x+2×436-413×3-343-465=-99,解之得x=1076,故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b),故答案为:<;
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2,故答案为:<;
而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.只要反应发生就有H2的消耗速率是CH3OH生成速率的2倍,故错误;
b.CH3OH的体积分数不再改变,说明各物质的量不变,反应达平衡状态,故正确;
c.混合气体的密度不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
d.CO和CH3OH的物质的量之和保持不变,可能平衡也可能未平衡,故错误;
故选bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,Kp═$\frac{\frac{0.5}{2}×0.5}{\frac{0.5}{2}×0.5×(\frac{1}{2}×0.5)^{2}}$=1.6×10-7 (kPa)-2,故答案为:1.6×10-7 (kPa)-2;
(3)由图l可知,随着温度升高,K1减小,则反应1:CO2(g)+H2(g)?CO(g)+H2O(g)△H1<0,反应3由反应1+2所得,根据盖斯定律:△H3=△H1+△H2,所以△H2>△H3,
故答案为:>;曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析和化学平衡常数的计算.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
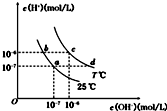
| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C |
| D | E | F |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
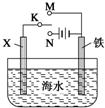 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.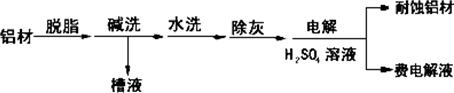
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
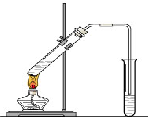 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 0.9 | C. | 0.45 | D. | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com