
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
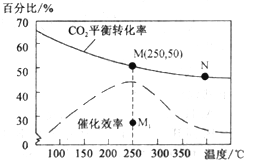
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。
【答案】+41.19kJmol1 较低温度 BD ABD Ag2CrO4>AgCl>AgBr>AgI>Ag2S 3×10-3 D Al(OH)3; 不含有
【解析】
(1)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=49.58kJmol1,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2,反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=90.77kJmol1,根据盖斯定律:Ⅱ=ⅠⅢ得反应②的△H2=+41.19kJmol1;
故答案为:+41.19kJmol1;
(2)△G=△HT△S<0时,反应能够自发进行,该反应的△S<0、△H<0,当温度较低时,反应Ⅲ能够自发进行,
故答案为:较低温度;
(3)A.由于气体的质量、体积不变,则无论是否达到平衡状态,混合气体的密度都不变化,不能作为判断是否平衡的依据,故A错误;
B. 反应前后气体的物质的量不等,混合气体的平均相对分子质量不再变化,可说明气体的物质的量不再变化,说明达到平衡状态,故B正确;
C. 平衡常数未知,CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1,不能判断是否达到平衡状态,故C错误;
D. 甲醇的百分含量不再变化,可说明达到平衡状态,故D正确。
故答案为:BD;
(4)A.化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A错误;
B. 温度低于250℃时,随温度升高平衡逆向进行,甲醇的产率减小,故B错误;
C. 升高温度二氧化碳的平衡转化率减小,则升温平衡逆向移动,所以M化学平衡常数大于N,故C正确;
D. 为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故D错误;
故答案为:ABD;
(5) ① 20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度可以计算得到:
Ksp(AgCl)=c(Ag+)×c(Cl-)=2.0×10-10,c(Ag+)=![]() ≈1.34×10-5mol/L,
≈1.34×10-5mol/L,
Ksp(AgBr)=c(Ag+)×c(Br-)=5.4×10-13,c(Ag+)=![]() ≈7.3×10-7mol/L,
≈7.3×10-7mol/L,
Ksp(AgI)=c(Ag+)×c(I-)=8.3×10-17,c(Ag+)=![]() ≈9.1×10-9mol/L,
≈9.1×10-9mol/L,
Ksp(Ag2S)=c(Ag+)2×c(S2-)=c(Ag+)2×0.5×c(Ag+)=0.5×c(Ag+)3=,6.3×10-50,c(Ag+)=![]() ≈5.01×10-17mol/L;
≈5.01×10-17mol/L;
Ksp(Ag2CrO4)=c(Ag+)2×c(CrO42-)=c(Ag+)2×12×c(Ag+)=12×c(Ag+)3=2.0×10-12,c(Ag+)=![]() ≈1.59×10-4mol/L;
≈1.59×10-4mol/L;
所以三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S;
故答案为:Ag2CrO4>AgCl>AgBr>AgI>Ag2S;
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,依据溶度积常数判断AgBr的溶解度小于AgCl溶解度,AgCl+Br-=AgBr+Cl-,![]() =3×10-3,
=3×10-3,
故答案为:3×10-3;
③指示剂的作用是为了准确表示反应达到了终点,所以需要现象明显,同时不能影响反应的正常进行,根据数据可知,饱和时只有Ag2CrO4中的c(Ag+)比AgCl中的c(Ag+)大,说明在AgCl沉淀完全后再产生
故答案为:D;
(6)①根据Al(OH)3、Cu(OH)2的溶度积常数,在25℃下,向浓度均为0.1molL1的AlCl3和CuCl2混合溶液中逐滴加入氨水, ![]() ,加入相同的浓度的氨水,则Al(OH)3最先析出,
,加入相同的浓度的氨水,则Al(OH)3最先析出,
故答案为:Al(OH)3;
②Fe3+完全沉淀时,c(OH)3=![]() =4.0×10-33,c(Al3+)c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀,故答案为:不含有。
=4.0×10-33,c(Al3+)c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀,故答案为:不含有。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e- =N2+6H+
D. 当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可以实现的是
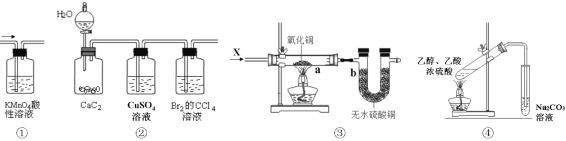
A. 装置①可检验溴乙烷发生消去反应得到的气体为乙烯
B. 装置②中的CuSO4溶液可用于除去杂质
C. 装置③a处有红色物质生成,b处变蓝,证明X一定是H2
D. 装置④可用于实验室制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中原子化热、晶格能、键能的单位都是kJmol﹣1

则下列说法正确的是
A. Na(s)与Cl2(g)反应生成1mol NaCl(s)放出的热量为556.1kJ
B. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJmol﹣1
C. 从表中可以看出,氯化钠的熔点比晶体硅高
D. 从表中数据可以看出,微粒半径越大金属键、离子键越弱,而共价键却越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列物质能导电且属于电解质的是(_______)
A.固态氯化镁(MgCl2) B.液态氯化镁(MgCl2)
C.氯化钠溶液 D.铝
(2)写出下列物质在水溶液中的电离方程式:
①Na2CO3______________________;
②H2SO4_____________________;
③NH3·H2O_______________。
(3)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是_____;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、Ca2+、NO、CO![]() 、SO
、SO![]() 、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
①加稀盐酸后,生成无色无味的气体,该气体能使澄清石灰水变浑浊。
②加足量的BaCl2产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
③取②中滤液,加硝酸酸化后,再加过量的AgNO3溶液,析出白色沉淀。
(1)上述3个实验证明一定存在的离子是__________,一定不存在的离子是________,可能存在的离子为_______________。
(2)写出①中涉及反应的离子反应方程式: _____________________________。
(3)实验室中常用于检验Na+是否存在的方法叫___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为配制250mL0.2mol·L-1Na2CO3的溶液的示意图。


回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是___(填字母)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
(2)①中称得Na2CO3___g。
(3)玻璃棒在②、③两步中的作用分别是___、____。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时仰视____;
B.在第⑤步不慎有少量液体流到容量瓶外____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下:
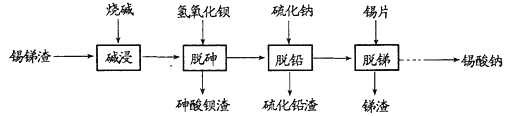
请回答下列问题:
(1)Sn(ⅣA)、As(VA)、Sb(VA)三种元素中,As和Sb最高正化合价为___________,Sn的原子序数为50,其原子结构示意图为___________。
(2)从溶液中得到锡酸钠晶体的实验操作是___________、趁热过滤、干燥。
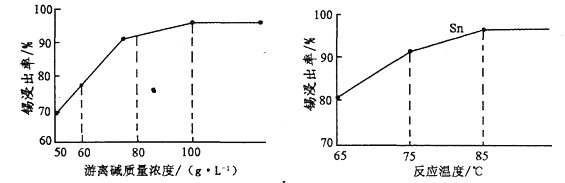
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是______________________;如图是“碱浸”实验的参数,请选择“碱浸”的合适条件_________________________________。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时发生的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com