
分析 0.125g金属镁的物质的量为n(Mg)=$\frac{m}{M}$=$\frac{0.125g}{24g/mol}$=0.0052mol,n(硫酸)=0.02mol,根据Mg+2H+=Mg2++H2↑计算生成氢气的物质的量,再根据物质的量之比等于体积比计算1mol氢气的体积.
解答 解:0.125g金属镁的物质的量为n(Mg)=$\frac{m}{M}$=$\frac{0.125g}{24g/mol}$=0.0052mol,n(硫酸)=0.02mol,根据Mg+2H+=Mg2++H2↑可知生成氢气的物质的量为0.0052mol,
设1mol氢气的体积为VL,
则$\frac{0.0052mol}{1mol}=\frac{0.1235L}{VL}$,解得V=23.75L;
故答案为:23.75L.
点评 本题考查了有关方程式的计算、物质的计算等,注意根据方程式判断Mg和硫酸哪种过量,按照量少的计算,题目难度不大,明确相同条件下物质的量与体积之间的关系是解题的关键.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 | |
| B. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 | |
| D. | 将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Zn、Cu | C. | Fe、Cu | D. | Zn、Fe、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
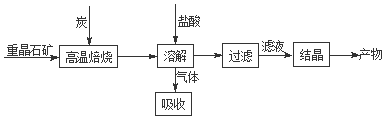
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
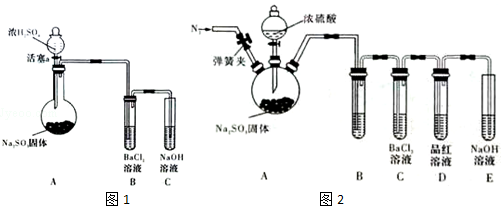
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
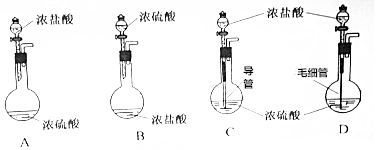
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
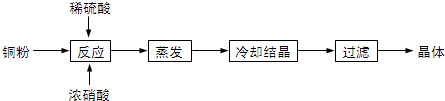
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com