
分析 (1)碳酸钙不溶于水,碳酸钠能溶于水;
(2)碳酸钾与盐酸反应生成氯化钾;
(3)碳酸钙高温分解生成氧化钙;
(4)二者的溶解度受温度影响不同.
解答 解:(1)碳酸钙不溶于水,碳酸钠能溶于水,则加适量水,过滤可分离,故答案为:a;
(2)碳酸钾与盐酸反应生成氯化钾,则加适量盐酸,蒸发可得到KCl,故答案为:c;
(3)碳酸钙高温分解生成氧化钙,则加热(高温或灼烧)可除杂,故答案为:b;
(4)二者的溶解度受温度影响不同,则冷却热的饱和溶液,过滤可除杂,故答案为:d.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析、应用及除杂的考查,注意除杂的方法和原则,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
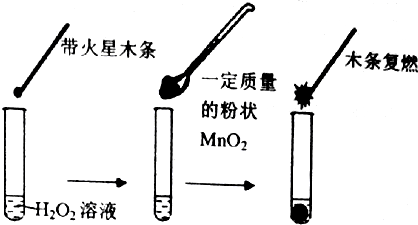
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
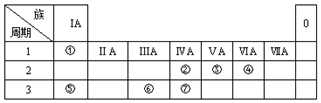
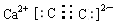 ,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.
,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:3CO+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
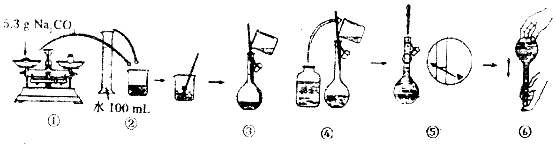
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
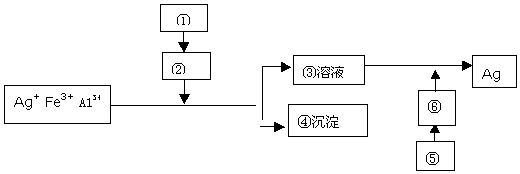
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com