
【题目】现有常见金属单质A、B和气体甲、乙及C、D、E、F之间发生如下反应(图中有些反应所需的反应条件和部分产物没有全部标出)。
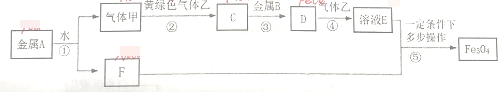
按要求回答下列问题:
(1)金属A元素在周期表中的位置为____;黄绿色气体乙的分子式为____;
(2)在①~⑤的反应中属于置换反应的有___;
(3)写出反应①的离子方程式____;
(4)写出反应④的离子方程式___;
(5)若33.6g的金属B完全反应,则在第④步反应中需消耗标准状况下__L的气体乙。
【答案】第三周期第IA族 Cl2 ①③ 2Na+2H2O=2Na++2OH-+H2↑ 2Fe2++Cl2=2Fe3++2Cl- 6.72
【解析】
金属A能与水反应生成气体甲,则甲为H2,黄绿色气体乙为Cl2,甲与乙反应生成C为HCl,由C ![]() D
D ![]() E转化,结合E与F多步操作有Fe3O4生成,可知B为Fe,则D为FeCl2、E为FeCl3.可推知A为Na、F为NaOH。
E转化,结合E与F多步操作有Fe3O4生成,可知B为Fe,则D为FeCl2、E为FeCl3.可推知A为Na、F为NaOH。
金属A能与水反应生成气体甲,则甲为H2,黄绿色气体乙为Cl2,甲与乙反应生成C为HCl,由C ![]() D
D ![]() E转化,结合E与F多步操作有Fe3O4生成,可知B为Fe,则D为FeCl2、E为FeCl3.可推知A为Na、F为NaOH。
E转化,结合E与F多步操作有Fe3O4生成,可知B为Fe,则D为FeCl2、E为FeCl3.可推知A为Na、F为NaOH。
(1)金属A为Na,元素在周期表中的位置为:第三周期第IA族;黄绿色气体乙的分子式为 Cl2;
(2)在①~⑤的反应中Na与水的反应、Fe与盐酸的反应属于置换反应,故答案为:①③;
(3)反应①是Na与水的反应,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(4)反应④氯化亚铁与氯气反应生成氯化铁,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
(5)n(Fe2+ )=n(Fe)=33.6g÷56g/mol=0.6mol,由2Fe2++Cl2=2Fe3++2Cl-,可知n(Cl2)=![]() n(Fe2+)=
n(Fe2+)=![]() ×0.6mol=0.3mol,故标准状况下消耗氯气为:0.3mol×22.4L/mol=6.72L。
×0.6mol=0.3mol,故标准状况下消耗氯气为:0.3mol×22.4L/mol=6.72L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物G是一种香料,可采用丙烯和甲苯为主要原料按下列路线合成:
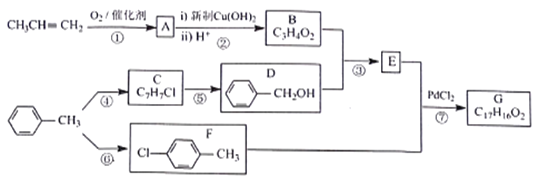
已知:①A的相对分子质量为56,其中氧的质量分数为28.6%
回答下列问题:
(1)A的分子式为___________,F的名称是__________
(2)B中含有的官能团名称为 __________________
(3)③的反应类型为_____________,反应⑤的试剂及条件为___________
(4)反应⑦的化学方程式为__________________
(5)X比D多1个CH2原子团,X的同分异构体中,能与FeCl3溶液发生显色反应的有______种,写出一种属于D的同系物且能发生消去反应的X的结构简式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
(3)该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:__________→_________ →_______ →抽滤(与过滤类似)→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)

(4)白色固体B中的杂质是____________。
(5)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是
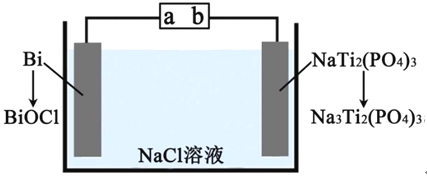
A. 充电时,a为电源正极
B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动
C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3
D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
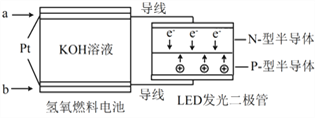
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。
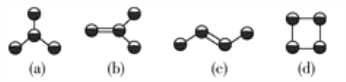
(1)写出有机物(b)的系统命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
(4)等质量的上述四种物质完全燃烧耗氧量最大的是______(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
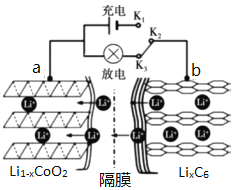
①放电时,电流从______(填“a”或“b”)极流出。
②充电时,a极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
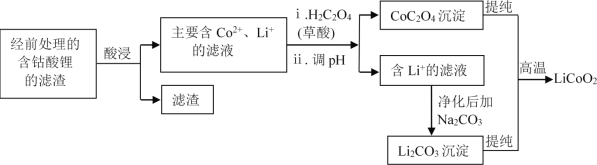
①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
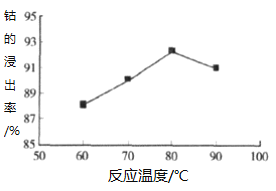
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:______。
④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。在一定条件下的以下反应中,最符合绿色化学概念的是( )
A. 用水吸收二氧化氮得到硝酸B. 铝盐溶液与氨水反应制氢氧化铝
C. 苯与液溴反应制溴苯D. 乙烯与氯化氢反应制备氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物经燃烧生成44.0gCO2和14.4gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的—C≡C—键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________________________________。
(2)下列物质中,一定条件下能与A发生反应的是________。
A.H2 B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com