
| A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性 |
| B.不能用稀硝酸与锌反应制氢气——强氧化性 |
| C.要用棕色瓶盛装浓硝酸——不稳定性 |
| D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.② | B.④ | C.②④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验步骤 | 实验现象 |
| ①a和b相混合 | 气体变为红棕色 |
| ②c和d相混合 | 产生白烟 |
| ③c、e分别通入少量溴水中 | 都变成无色透明的溶液 |
| ④b、e分别通入氢硫酸中 | 都产生淡黄色的浑浊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.40mL 1 mol?L-1的稀硝酸溶液 | B.40mL 0.5 mol?L-1的稀硫液液 |
| C.40mL 1 mol?L-1的FeCl3溶液 | D.60mL 0.5 mol?L-1的稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu+稀HNO3 | B.Cu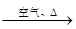 CuO CuO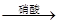 Cu(NO3)2 Cu(NO3)2 |
| C.Cu+浓HNO3 | D.Cu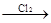 CuCl2 CuCl2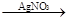 Cu(NO3)2 Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都应用棕色广口瓶存储 |
| B.浓度不同的两种HNO3(aq) |
| C.溶液的体积不同但浓度相同 |
| D.均可与Au反应而发生钝化现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
| A.实验室制氧气的装置 | B.实验室制氢气的装置 |
| C.实验室制二氧化碳的装置 | D.实验室制氯气的装置 |

 。
。 即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com